
【题目】完成下列填空
(1)决定物质体积的因素有 ①构成物质的粒子数;②粒子大小;③粒子间的距离。对固体、液体物质而言,它主要是由上述______决定(填写编号,下同);对气体物质而言,它主要由上述_____决定。
(2)标准状况下,体积为11.2 L 的CO2的 质量______g,其所含原子的总数是______ 个。
(3)配制100 mL2 molL-1的H2SO4溶液,需要某98%H2SO4溶液(密度为1.8g/cm-3)的体积为________ml(保留三位有效数字)。取配制后的溶液20ml,SO42-的物质的量为______,加入足量的锌,生成标况下氢气的体积为:______ L。
【答案】 ①② ①③ 22 1.5×6.02×1023 1 1.1 0.04 mol 0.896
【解析】(1)相同物质粒子数目越大,占有的体积越大对固体、液体物质而言,粒子大小远远大于粒子间的距离,可以忽略粒子间的距离,故构成物质的粒子数及粒子大小决定固体、液体的体积;而对气体物质而言,粒子间的距离远远大于粒子大小,可以忽略粒子大小,故构成物质的粒子数、粒子间的距离决定气体体积大小,故固体、液体物质而言,它主要是由上述①②决定;对气体物质而言,它主要由上述①③决定;
(2)标况下,11.2L二氧化碳的物质的量为: ![]() =0.5mol,其质量为0.5mol×44g/mol=22g,则含有原子数为N=nNA=3×0.5mol×6.02×1023=1.5×6.02×1023;
=0.5mol,其质量为0.5mol×44g/mol=22g,则含有原子数为N=nNA=3×0.5mol×6.02×1023=1.5×6.02×1023;
(3)根据c=![]() 可知,浓硫酸物质的量浓度为:
可知,浓硫酸物质的量浓度为: ![]() mol/L=18mol/L,根据稀释定律,需要浓硫酸的体积为:
mol/L=18mol/L,根据稀释定律,需要浓硫酸的体积为: ![]() =11.1mL;20mL溶液中n(H2SO4)=0.02L×2mol/L=0.04mol,则n(SO42-)=n(H2SO4)=0.04mol,根据H原子守恒,生成氢气的物质的量为0.04mol,标况下生成氢气体积为:0.04mol×22.4L/mol=0.896L。
=11.1mL;20mL溶液中n(H2SO4)=0.02L×2mol/L=0.04mol,则n(SO42-)=n(H2SO4)=0.04mol,根据H原子守恒,生成氢气的物质的量为0.04mol,标况下生成氢气体积为:0.04mol×22.4L/mol=0.896L。


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、W有如图所示的转化关系,则X、Y可能是

① C、CO ② AlCl3 、Al(OH)3 ③ Na、 Na2O
④ NaOH 、Na2CO3 ⑤ AlO2 -、Al(OH)3 ⑥ Fe、Cl2
A. ①②⑥ B. ①②③④⑤
C. ①②③④⑤⑥ D. ①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的叙述中,错误的是
A. 水玻璃是制取水泥的原料
B. 二氧化硅是制造光导纤维的材料
C. 硅是制造太阳能电池的常用材料
D. 纤维常用做复合材料的增强体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中的实线表示元素周期表的部分边界。①~⑤分别表示元素周期表中对应位置的元素。

(1)元素③④⑤的氢化物的稳定性由强到弱的顺序是____________________ (用氢化物的化学式表示)。
(2)元素③一般在化合物中显________价,但在与______形成化合物时,所显示的价态正好相反。
(3)M、N两种化合物均由①②③④四种元素组成,写出此两种化合物在水溶液中发生反应的离子方程式:____________________________________。
(4)X、Y、Z代表原子序数依次增大的三种短周期元素。在周期表中,Y与X相邻,Y与Z也相邻;X、Y和Z三种元素原子的最外层电子数之和为17;X、Y、Z三种元素有的是上表中编号①~⑤的元素,有的不是,请在上表中用元素符号标出不是①~⑤元素的相应位置。___________
(5)某同学受镧系、锕系元素排列方式的启发,将元素周期表设计成下列更简明的形式,把118种元素全部排列在内,表中除A、B、C、D外每个位置只表示一种元素。则该表中的A位置包含________(填数字)种元素。C位置中的元素是否全部是金属元素________(填“是”或“否”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家对一碳化学进行了广泛深入的研究并取得了一些重要成果。
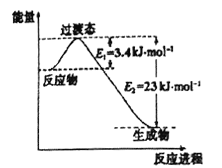
(1)目前工业上有一种方法是用CO2和H2在230℃催化剂条件下转化生成甲醇蒸汽和水蒸气。下图表示恒压容器中0.5molCO2和1.5molH2转化率达80%时的能量变化示意图。写出该反应的热化学方程式:__________________。
(2)现向三个体积均为2L的恒容密闭容器Ⅰ、Ⅱ、Ⅲ中均分别充入lmolCO和2molH2发生反应:CO(g)+2H2(g)![]() CH3OH(g) △H1=-90.1kJ/mol。三个容器的反应温度分别为T1、T2、T3且恒定不变,当反应均进行到5min时H2的体积分数如图所示,其中只有一个容器中的反应己经达到平衡状态.
CH3OH(g) △H1=-90.1kJ/mol。三个容器的反应温度分别为T1、T2、T3且恒定不变,当反应均进行到5min时H2的体积分数如图所示,其中只有一个容器中的反应己经达到平衡状态.

① 三个容器中一定达到平衡状态的是容器_____(填序号,下同)
②0~5min时间内容器I中用CH3OH表示的化学反应速率为__________。
③ 当三个容器中的反应均达到平衡状态时CO 的转化率最高的是容器_____;平衡常数最小的是容器______。
(3)CO常用于工业冶炼金属.右下图是在不同温度下CO还原四种金属氧化物达平衡后气体中lg[![]() ]与温度(t)的关系曲线图。下列说法正确的是_______。
]与温度(t)的关系曲线图。下列说法正确的是_______。
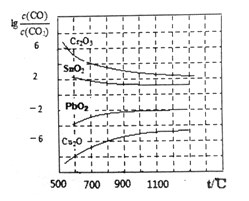
A.工业上可以通过增高反应装置来延长矿石和CO接触的时间,减少尾气中CO的含量
B.CO不适宜用于工业冶炼金属铬(Cr)
C.工业冶炼金属铜(Cu)时较低的温度有利于提高CO的利用率
D.CO还原PbO2的反应△H>O
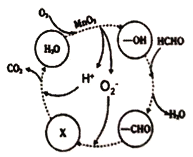
(4)某工厂工业废水中含有甲醛,该厂降解甲醛的反应机理如图所示,则X表示的粒子是____,总反应的化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钠既能跟氧气、水等无机物反应,也能跟酒精、醋酸等有机物反应。要研究金属钠跟酒精的反应以及它与水反应的异同点,下列研究方法中没有用到的是
A. 实验法 B. 观察法 C. 分类法 D. 比较法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】针对实验室制取氨气,下列说法不正确的是
A. 发生装置与用KClO3制取O2的装置相同
B. 可用浓硫酸干燥氨气
C. 可用向下排空气法收集氨气
D. 氨气的验满可以用蘸有浓盐酸的玻璃棒放于试管口附近
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,某容积固定的密闭容器由可移动的活塞隔成A、B两室,分别向A、B两室充入H2、O2的混合气体和1 mol空气,此时活塞的位置如图所示。

(1)A室混合气体的物质的量为________,所含分子总数为________。
(2)实验测得A室混合气体的质量为34 g,则该混合气体的密度是同温同压条件下氦气密度的________倍。
(3)若将A室H2、O2的混合气体点燃引爆,恢复原温度后,最终活塞停留的位置在________刻度,容器内气体压强与反应前气体压强之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在FeCl2和AlCl3的混合溶液中加入过量的氨水,直至溶液中沉淀的量不再改变为止。经过滤、洗涤、干燥、在空气中灼烧,最终剩余固体的成分是 ( )
A.Fe2O3、Al2O3 B.Fe2O3
C.Fe (OH)2、Al(OH)3 D.Fe(OH)3、Al(OH)3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com