
| A. | 浓硫酸、水 | B. | 饱和食盐水、浓H2SO4 | ||
| C. | 烧碱、石灰水 | D. | 无水CaCl2、烧碱 |
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 洗净的锥形瓶和容量瓶可以放进烘箱中烘干 | |
| B. | 滴定管装滴定液前应先用该溶液润洗 | |
| C. | 分液漏斗和蒸馏烧瓶使用前都要检查是否漏液 | |
| D. | 配制溶液时,只要容量瓶的容积符合要求就可以直接使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠溶液中通入过量二氧化碳:OH-+CO2═HCO3- | |
| B. | 碳酸钙溶于稀醋酸:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 向碳酸氢铵稀溶液中加入过量烧碱溶液:NH4++OH-═NH3H2O | |
| D. | 钠与水的反应:Na+H2O═Na++OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 电池工作时,负极附近溶液的pH升高 | |
| B. | 电路中转移2mol电子,理论上约消耗标准状况下空气56L | |
| C. | 电池工作时,电流由M极经外电路流向N极 | |
| D. | 电池总反应为4Al+3O2=2Al2O3、2Mg+O2=2MgO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 乙酸 | 乙醇 | |
| 熔点/℃ | 16.6 | -114.3 |
| 沸点/℃ | 117.9 | 78.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 写成2aA+2bB?2cC,Q值、K值均扩大了一倍 | |
| B. | 写成2aA+2bB?2cC,Q值扩大了一倍,K值保持不变 | |
| C. | 写成cC?aA+bB,Q值、K值变为原来的相反数 | |
| D. | 写成cC?aA+bB,Q值变为原来的相反数,K值变为倒数 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
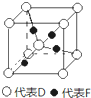 在周期表中1~36号之间的A、B、C、D、E、F六种元素,它们的原子序数依次增大,已知A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C元素原子的最外层有3个自旋方向相同的未成对电子,D原子核外电子有8种不同的运动状态,E元素在第四周期,E的基态原子中未成对电子数是核外电子总数的1/4,F元素位于周期表的ds区,其基态原子最外能层只有一个电子.
在周期表中1~36号之间的A、B、C、D、E、F六种元素,它们的原子序数依次增大,已知A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C元素原子的最外层有3个自旋方向相同的未成对电子,D原子核外电子有8种不同的运动状态,E元素在第四周期,E的基态原子中未成对电子数是核外电子总数的1/4,F元素位于周期表的ds区,其基态原子最外能层只有一个电子.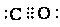 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
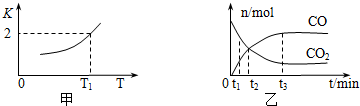
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com