
【题目】以NA 表示阿伏加德罗常数的值,下列说法正确的是
A. T ℃时,1 L pH=6的纯水中,含10-8NA个![]()
B. 15.6 g Na2O2与过量CO2反应时,转移的电子数为0.4NA
C. 1 mol SiO2中含有30 mol 电子
D. 14 g分子式为CnH2n的(n≥2)链烃中含有的C=C的数目一定为NA
【答案】C
【解析】A、H2O的电离方程式为H2O![]() H++OH-,T℃时纯水的pH=6,得出水的离子积为Kw=c(H+)×c(OH-)=10-6×10-6=10-12,即含有OH-的物质的量为10-6mol,故A错误;B、发生2Na2O2+2CO2=2Na2CO3+O2,2molNa2O2转移电子物质的量为2mol,因此15.6gNa2O2参与此反应,转移电子物质的量为15.6/78mol=0.2mol,故B错误;C、1molSiO2中含有电子物质的量为(14+2×8)mol=30mol,故C正确;D、CnH2n为链烃,即CnH2n为单烯烃,1mol单烯烃中含有1mol碳碳双键,即14g单烯烃中含有碳碳双键的物质的量为14/14nmol,即含有碳碳双键的物质的量为1/nmol,故D错误。
H++OH-,T℃时纯水的pH=6,得出水的离子积为Kw=c(H+)×c(OH-)=10-6×10-6=10-12,即含有OH-的物质的量为10-6mol,故A错误;B、发生2Na2O2+2CO2=2Na2CO3+O2,2molNa2O2转移电子物质的量为2mol,因此15.6gNa2O2参与此反应,转移电子物质的量为15.6/78mol=0.2mol,故B错误;C、1molSiO2中含有电子物质的量为(14+2×8)mol=30mol,故C正确;D、CnH2n为链烃,即CnH2n为单烯烃,1mol单烯烃中含有1mol碳碳双键,即14g单烯烃中含有碳碳双键的物质的量为14/14nmol,即含有碳碳双键的物质的量为1/nmol,故D错误。


科目:高中化学 来源: 题型:
【题目】苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线:
![]() +H2O+H2SO4
+H2O+H2SO4![]()
![]() +NH4HSO4
+NH4HSO4
![]() + Cu(OH)2
+ Cu(OH)2![]()
![]() +H2O
+H2O
制备苯乙酸的装置示意图如图(加热和夹持装置等略)。
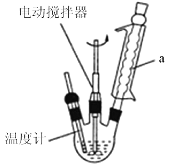
己知: 苯乙酸的熔点为76.5℃,可升华,易溶于热水,微溶于冷水,溶于乙醇。
请回答下列问题:
(1)将装置中的溶液加热至100℃,缓缓滴加40g 苯乙腈到硫酸溶液中,然后升温至130℃继续反应,在装置示意图中,仪器a的名称是________,其作用是_____________;
(2)反应结束后加适量冷水,可分离出苯乙酸粗品,其加入冷水的目的是____________;下列仪器中可用于分离苯乙酸粗品的是_______(填标号)。
A.分液漏斗 B.漏斗 C.烧杯 D.直形冷凝管 E.玻璃棒
(3)如果要将苯乙酸粗品进一步提纯,你选择的实验方法是___________(填二种方法)。
(4)用CuCl2·2H2O和NaOH 溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是____________;
(5)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是____________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用钒炉渣(主要含FeO·V2O5,还有少量SiO2、P2O5等杂质)提取V2O5的流程如下:

(1)焙烧的目的是将FeO·V2O3转化为可溶性NaVO3,该过程中被氧化的元素是_______________;浸出渣的主要成分为____________________(填化学式)。
(2)用MgSO4溶液除硅、磷时,滤渣的主要成分为__________。
(3)在焙烧NH4VO3的过程中,固体质量的减少值(纵坐标)随温度变化的曲线如图所示,210℃时,剩余固体物质的化学式为_____________________。

(4)由V2O5冶炼金属钒采用铝热法,引发铝热反应的实验操作是__________________.
(5)将V2O5溶于足量稀硫酸得到250mL(VO2)2SO4溶液。取25.00mL该溶液于锥形瓶中,用0.1000 mol·L-1H2C2O4标准溶液进行滴定,达到滴定终点时消耗标准溶液的体积为20.00mL。已知滴定过程中H2C2O4被氧化为CO2,VO2+(黄色)被还原为VO2+(蓝色)。
①该滴定实验不需要另外加入指示剂,达到滴定终点的现象是___________________。
②(VO2)2SO4溶液中溶质的物质的量浓度为___________________。
③达到滴定终点时,俯视滴定管读数将使结果_________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向甲、乙两个容积均为1 L的恒容容器中。现向甲中充入2 mol A、2 mol B,乙中充入1 mol A、1 mol B。相同温度下发生反应:A(g)+B(g) ![]() xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示。下列说法正确的是 ( )
xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示。下列说法正确的是 ( )


A. x不可能等于1
B. 甲、乙两容器中反应达平衡时,平衡常数K甲<K乙
C. 将乙容器升温可使甲、乙容器内各物质的体积分数相同
D. 若向甲容器中再充入2 mol A、2 mol B,则平衡时甲中0.78 mol·L-1<c(A)<1.56 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,4- 二苯基丁烷是用来研究聚合物溶剂体系热力学性质的重要物质,工业上用下列方法制备1,4-二苯基丁烷:

友情提示:格拉泽反应:2R—C≡C—H ![]() R—C≡C—C≡C—R+H2
R—C≡C—C≡C—R+H2
回答下列问题:
(1)D的官能团的名称为_____________________。
(2)①和③的反应类型分别为____________、_____________。
(3)E的结构简式为_________________________________。用1 mol E合成1,4-二苯基丁烷,理论上需要消耗氢气________mol。
(4)请写出反应①的化学方程式______________________________。
(5)化合物C在氢氧化钠的水溶液中加热可得到化合物F,请写出化合物F和乙酸反应的化学方程式______________________________________。
(6)芳香化合物G是C的同分异构体,其分子中只有两种不同化学环境的氢,数目比为1:1,写出其结构简式_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入X并发生反应:2X(g)![]() Y(g),温度T1、T2下X的物质的量浓度C(X)随时间t变化的曲线如图所示,下列叙述正确的是( )
Y(g),温度T1、T2下X的物质的量浓度C(X)随时间t变化的曲线如图所示,下列叙述正确的是( )

A. 该反应进行到M点放出的热量大于进行到W点放出的热量
B. T2 下,在 0t1时间内,v(Y)=b/t1 mol·L-1·min-1
C. M点的正反应速率v 正大于N点的逆反应速率v逆
D. M点时再加入一定量X,平衡后X的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究浓硫酸的性质,设计了如下图所示的装置进行实验. 
(1)用“可抽动的铁丝”代替“直接投入铁片”的优点是 .
(2)说明SO2气体产生的实验现象是;装置C的作用是 .
(3)反应一段时间后,他们对试管A中溶液的金属离子进行探究,请完成相关试题:
①提出假设:假设1:只含有Fe3+;
假设2:只含有Fe2+;
假设3:既有Fe2+ , 又有Fe3+ .
②请设计实验方案验证假设3.
限选试剂:稀硫酸、KMnO4溶液、KSCN溶液、NaOH溶液、H2O2溶液.
实验步骤 | 预期现象 |
步骤一:用胶头滴管取出A试管中的溶液,用水稀释后,并分装在试管Ⅰ、Ⅱ中备用 | |
步骤二:检验Fe3+ , 往试管Ⅰ中, | |
步骤三:检验Fe2+ , 往试管Ⅱ中, |
(4)已知C+2H2SO4(浓) ![]() 2SO2↑+CO2↑+2H2O,该反应体现浓硫酸的性.
2SO2↑+CO2↑+2H2O,该反应体现浓硫酸的性.
A.脱水性 B.强氧化性 C.吸水性
若要验证反应产物中同时混有SO2气体和CO2气体,可选择以下试剂进行实验:
①NaOH溶液②品红溶液③溴水④Ca(OH)2溶液,选择合适试剂并安排合理的顺序为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com