
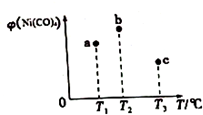
 在容积均为1L的三个密闭容器中,分别放入镍粉并充入1molCO,控制作在不同温度下发生反应:Ni(s)+4CO(g)?Ni(CO)4(g),当反应进行到5min时,测得Ni(CO)4的体积分数与温度的关系如图所示.下列说法正确的是( )
在容积均为1L的三个密闭容器中,分别放入镍粉并充入1molCO,控制作在不同温度下发生反应:Ni(s)+4CO(g)?Ni(CO)4(g),当反应进行到5min时,测得Ni(CO)4的体积分数与温度的关系如图所示.下列说法正确的是( )| A. | 正反应为吸热反应,平衡常数:K(T1)>K(T2) | |
| B. | 反应进行到5min时,b容器中v(正)=v(逆) | |
| C. | 达到平衡时,a、b、c中CO的转化率为b>a>c | |
| D. | 减压或升温可将b中的平衡状态转变成c中的平衡状态 |
分析 A.根据升高温度平衡移动的方向判断反应热;
B.未到达平衡前,升高温度Ni(CO)4的含量增大,到达平衡后再升高温度,平衡向逆反应方向移动,Ni(CO)4的含量降低,而5min时,b容器中Ni(CO)4的含量不一定最高,不一定是平衡状态;
C.根据温度对平衡的影响来判断,升高温度平衡逆向移动,CO的转化率减小;
D.b中的平衡状态转变成c中的平衡状态,Ni(CO)4的体积分数减小,说明平衡逆向移动,根据方程式的特点,升高温度或减压都可以.
解答 解:A.升高温度,甲Ni(CO)4百分含量减小,说明正反应是放热反应,则△H<0,故A错误;
B.5min时,b容器中Ni(CO)4的含量不一定最高,不一定是平衡状态,则v(正)、v(逆)不一定相等,故B错误;
C.达到平衡时,a、b、c三个容器的反应温度不同,a容器温度最低,c容器的反应温度最高,根据反应放热可判断出,升高温度,平衡逆向移动,Ni(CO)4的体积分数减小,故应为a>b>c,故C错误;
D.b中的平衡状态转变成c中的平衡状态,Ni(CO)4的体积分数减小,说明平衡逆向移动,根据方程式的特点,减小压强或升高温度平衡逆向移动,故D正确.
故选D.
点评 本题考查化学平衡图象题,难度较大,B选项为易错点,学生容易认为b容器到达平衡,注意从图象中曲线的变化趋势分析条件改变导致平衡移动的特点.


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18.75% | B. | 30% | C. | 15% | D. | 22.5% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,在某弱酸HA溶液中加入NaA固体后,$\frac{c(HA)•c(O{H}^{-})}{c({A}^{-})}$减小 | |
| B. | 将适量CO2 通入0.1 mol•L-1Na2CO3溶液中至溶液恰好呈中性,则溶液中(不考虑溶液体积变化) 2c(CO32-)+c(HCO3-)=0.1 mol•L-1 | |
| C. | 常温下,0.1 mol•L-1的NH4HCO3溶液其pH=7.8,则Kb(NH3•H2O)>Ka1(H2CO3) | |
| D. | 已知常温低下Ksp(AgI)=2.0×10-16,在AgI悬浊液中加入少量KI粉末,AgI(s)?Ag+(aq)+I-(aq)平衡向左移动,溶液中离子的总浓度会减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
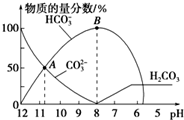 常温下,在10mL0.1mol•L-1Na2CO3溶液中逐渐加入0.1mol•L-1的盐酸,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数的变化如图所示(CO2因逸出未画出,忽略气体逸出而引起的溶液体积变化),下列说法正确的是( )
常温下,在10mL0.1mol•L-1Na2CO3溶液中逐渐加入0.1mol•L-1的盐酸,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数的变化如图所示(CO2因逸出未画出,忽略气体逸出而引起的溶液体积变化),下列说法正确的是( )| A. | 在A点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) | |
| B. | 在B点所示的溶液中,浓度最大的离子是HCO3- | |
| C. | 当溶液的pH为7时,溶液中的阴离子只有两种 | |
| D. | 25℃时,HCO3-的电离平衡常数Ka=5×10-11,当溶液的pH=10时,c(HCO3-)=2c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
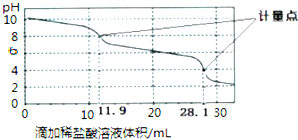
| A. | 此样品中NaHCO3的物质的量为(28.1-11.9)×10-4mol | |
| B. | 整个滴定过程中,溶液中阴离子总数始终不变 | |
| C. | 滴加稀盐酸的体积为11.90mL时:c(H+)+c(H2CO3)═c(OH-)+c(CO32-) | |
| D. | 该方法无法测定Na2CO3和NaOH混合溶液中NaOH的含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该 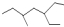 有机物的系统命名为:3-乙基-5-甲基庚烷 有机物的系统命名为:3-乙基-5-甲基庚烷 | |
| B. | 棉花、羊毛、合成纤维、油脂的成分都是高分子化合物 | |
| C. | 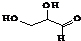 该有机物属于单糖,在一定条件下能发生取代、消去、加成、氧化、还原等反应 该有机物属于单糖,在一定条件下能发生取代、消去、加成、氧化、还原等反应 | |
| D. | 等质量的乙烯和乙醇完全燃烧消耗氧气的量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 35 | 50 | 60 | 70 | 80 |
| 温度/℃ | 25 | 26 | 26 | 26 | 26 | 26 | 26.5 | 27 | 27 | 27 | 27 |
| 操作 | 现象 |
| 向该绿色溶液中通入氮气(或向硝酸铜溶液中通入浓硝酸与铜反应产生的气体) | 溶液颜色变蓝(或绿色加深) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 石油液化气、汽油和石蜡的主要成分都是碳氢化合物 | |
| B. | CH3-CH=CH-CH3与C3H6一定互为同系物 | |
| C. | 用浸泡过高锰酸钾溶液的硅藻土吸收水果释放的乙烯,可达到水果保鲜的目的 | |
| D. | 等质量的乙烯和聚乙烯充分燃烧所需氧气的量不相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com