
| A. | 清晨的阳光穿过茂密的林木枝叶所产生的美丽的光线 | |
| B. | 向FeCl3溶液中滴加NaOH溶液出现红褐色沉淀 | |
| C. | 肾功能衰竭等疾病引起的尿中毒,可利用半透膜进行血液透析 | |
| D. | 在海水与河水交界处,易形成三角洲 |
分析 A、大气是胶体;
B、向FeCl3溶液中滴加NaOH溶液生成的是氢氧化铁沉淀;
C、血液是胶体;
D、河水是胶体,海水是电解质溶液.
解答 解:A、大气是胶体,故当有阳光穿过时有美丽的光线,是胶体的丁达尔效应,和胶体的性质有关,故A不选;
B、向FeCl3溶液中滴加NaOH溶液生成的是氢氧化铁沉淀,而不是氢氧化铁胶体,故B选;
C、血液是胶体,不能透过半透膜,故可以利用半透膜除去血液中的毒素,和胶体的性质有关,故C不选;
D、河水是胶体,海水是电解质溶液,故当河水遇到海水时,会产生胶体的聚沉,从而形成三角洲,故和胶体的性质有关,故D不选.
故选B.
点评 本题考查了胶体的常见的性质,难度不大,应注意的是氢氧化铁胶体的制备是将氯化铁溶液滴入沸水中制得.


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案科目:高中化学 来源: 题型:推断题
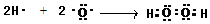 ;在微电子工业中,氨气的水溶液可用作刻蚀剂Y的清除剂,反应产物不污染环境,其化学方程式为2NH3?H2O+3H2O2=N2+8H2O或2NH3+3H2O2=N2+6H2O.
;在微电子工业中,氨气的水溶液可用作刻蚀剂Y的清除剂,反应产物不污染环境,其化学方程式为2NH3?H2O+3H2O2=N2+8H2O或2NH3+3H2O2=N2+6H2O.查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .
. ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甘油加水作护肤剂 | |
| B. | 医用酒精的浓度为75% (体积比浓度) | |
| C. | 福尔马林是甲醛的水溶液,具有杀菌防腐能力,因此可以用其保鲜鱼肉等食品 | |
| D. | 苯酚有毒但可以制成药皂,具有杀菌消毒的功效 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2的摩尔质量是32g | B. | 氯化钠的相对原子质量是58.5g | ||
| C. | 1molH2O的质量是18g | D. | 1molH2O含有氢原子的个数2个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑧ | B. | ①⑥ | C. | ②④ | D. | ③⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LH2O含有的分子数为1NA | |
| B. | 常温常压下,7.1g Cl2与足量的Fe充分反应,转移的电子数目为0.3 NA | |
| C. | 通常状况下,NA 个CO2分子占有的体积为22.4L | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,1L溶液中含有Cl-个数为1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
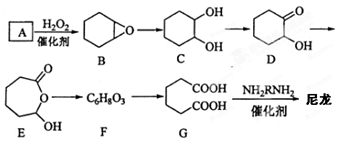
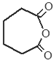 .
. .
.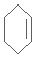 $\stackrel{Br_{2}/CCl_{4}}{→}$
$\stackrel{Br_{2}/CCl_{4}}{→}$ $→_{△}^{NaOH/C_{2}H_{5}OH}$
$→_{△}^{NaOH/C_{2}H_{5}OH}$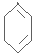 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com