
下列各项中,理由、结论及因果关系均正确的是 ( )
A.由于键能EN≡N> ECl-Cl,故单质的沸点:N2>Cl2
B.由于分子中可电离的H+个数H2SO4> CH3COOH,故两者的酸性:H2SO4>CH3COOH
C.由于元素的非金属性N>P,故氢化物的稳定性:NH3>PH3
D.由于金属性Fe>Cu, 故还原性Fe2+>Cu
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
下列反应中,改变反应物的用量或浓度,不会改变生成物的是( )
A.铜和硝酸反应
B.二氧化碳通入氢氧化钠溶液中
C.细铁丝在氯气中燃烧
D.氯化铝与氢氧化钠溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关糖类物质的叙述中正确的是( )
A.糖类是有甜味的物质
B.由碳、氢、氧三种元素组成的有机物属于糖类
C.葡萄糖和果糖互为同系物,蔗糖和麦芽糖互为同系物
D.糖可分为单糖、低聚糖和多糖
查看答案和解析>>
科目:高中化学 来源: 题型:
原子序数依次递增的X、Y、Z、W是周期表中前30号元素,其中只有X、Y同周期。已知
X的最外层电子数是其内层电子数的2倍;X与Y形成的常见化合物之一常被用于高炉炼
铁;Z与X同主族,其单质在同周期元素形成的单质中熔点最高;W原子M能层为全充满
状态,且核外的未成对电子只有一个。回答下列问题:
(1)从电负性角度分析,X,Y,Z三种元素的非金属活泼性由强到弱的顺序为 。
(2)X、Y分别与H形成的化学键的极性关系为X-H Y-H(填“<”、“>”或“=”)。
(3)+l价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第二
电离能I2,依次还有I3、I4、I5…,推测Z元素的电离能突增应出现在第____电离能。
(4)X的氢化物中X原子的杂化方式为sp2,则相对分子质量最小的分子式为____,
(5)W的价电子排布图为 ;下图____表示的是W晶体中微粒的堆积方式(填甲、乙或丙);若W晶体中一个晶胞的边长为a cm,则W晶体的密度为____(写出含a的表达式,用NA表示阿伏伽德罗常数)。
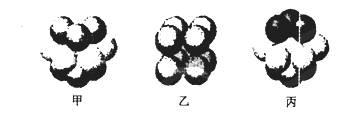
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2型分子;Y与M形成的气态化合物在标准状况下的密度为0.76 g/L; W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是
A.原子半径: W>Z>Y>X>M B.XZ2、X2M2、W2Z2均为直线形的共价化合物
C.由X元素形成的单质不一定是导体
D.由 X、Y、Z、M四种元素形成的化合物一定既含有离子键,又含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
C、N、O、Na、Al、S、Cl是常见的元素
(1)C元素位于元素周期表的位置 ;C元素的一种同位素可以测定文物年代,这种同位素的符号为 。
(2)用“>”、“<”或“=”填空
| 离子半径 | 酸性 | 还原性 | 得电子能力 |
| N3- Al3+ | H2SO4 HClO4 | O2- S2- | 35Cl 37Cl |
(3)黑火药爆炸时发生反应的化学方程式为:S+2KNO3 +3C==K2S +3CO2↑+N2↑反应生成物中,属于非电解质的是_______(写结构式);其中熔点最高的物质的电子式是_________。
(4)在(3)中化学反应方程式的元素中,属于同周期元素的非金属性由强到弱的顺序为_________,能证明其递变规律的事实是( )(填字母)
A.氧化物对应水化物的酸性 B.气态氢化物的沸点
C.单质与氢气反应的难易程度 D.氢化物的稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
如下图,铁有δ、γ、α三种同素异形体,三种晶体在不同温度下能发生转化。下列说法正确的是 ( )。
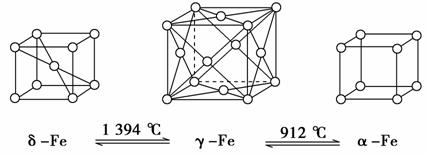
A.γFe晶体中与每个铁原子距离相等且最近的铁原子有6个
B.αFe晶体中与每个铁原子距离相等且最近的铁原子有6个
C.将铁加热到1 500℃分别急速冷却和缓慢冷却,得到的晶体类型相同
D.三种同素异形体的性质相同
查看答案和解析>>
科目:高中化学 来源: 题型:
偏二甲肼与N2O4 是常用的火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2 (l )+2N2O4 (l )=2CO2 (g )+3N2 (g )+4H2O (l ) (Ⅰ)
(1)若将反应(Ⅰ)设计成原电池,则正极的电极反应式为
(酸性电解质)。
(2)火箭残骸中常现红棕色气体,原因为:N2O4 (g) 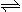 2NO2 (g) (Ⅱ)
2NO2 (g) (Ⅱ)
当温度升高时,气体颜色变深,则反应(Ⅱ)为 (填“吸热”或“放热”)反应。
(3)一定温度下,反应(Ⅱ)的焓变为ΔH。现将1 mol N2O4 充入一恒压密闭容器中,
下列示意图正确且能说明反应达到平衡状态的是________.
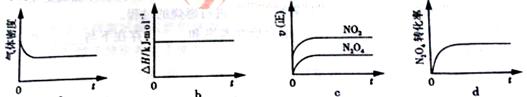
若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数________(填“增大”“不变”或“减小”),反应3s后NO2的物质的量为0.6mol,则0~3s内的平均反应速率v(N2O4)=________mol·L-1·s-1。
(4)NO2可用氨水吸收生成NH4NO3 。25℃时,将amol NH4NO3溶于水,溶液显酸性,原因是 (用离子方程式表示)。向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将______(填“正向”“不”或
“逆向”)移动,所滴加氨水的浓度为_______mol·L-1。(NH3·H2O的电离平衡常数
Kb=2×10—5 mol·L-1)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com