
【题目】对于反应A + B = C,下列条件的改变一定使化学反应速率加快的是
A.升高体系的温度 B.增加体系的压强
C.减少C的物质的量浓度 D.增加A的物质的量
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 在船体上镶嵌铜块,可以减缓船体被海水腐蚀的速率
B. 粗铜精炼时,电解液中的c(Cu2+)基本保持不变
C. 铁钉在氯化铵溶液中慢慢溶解,属于吸氧腐蚀
D. 在滴定实验中,可以用量筒量取21.00 mL的NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是
A.常温下,100g 46%乙醇水溶液中含有H原子数为12 NA
B.23g NA与足量O2反应,生成NA2O 和NA2O2 的混合物,转移的电子数为 NA
C.标准状况下,2.24 LCCl4 含有的共价键数为0.4 NA
D.1 molN2与4molH2反应生成的NH3分子数小于2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈.发生的反应体系中共有六种物质:NH4Cl、FeCl3、N2、Fe2O3、Fe和X。
(1)根据题意,可判断出X是_________(写化学式)。
(2)写出并配平该反应的化学方程式:_________;
(3)发生还原反应的物质是_________,反应中2mol的氧化剂能_________(填“失去”或“得到”)_________mol电子.
(4)反应中被氧化产生了5.6L(标准状况)的气体时,被还原的物质的质量为_________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有A+、B3+、C3+ 三种金属阳离子的水溶液发生了如下一系列变化:
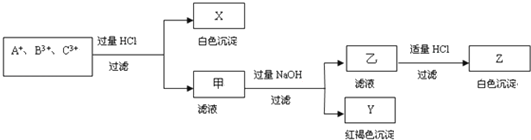
请通过分析回答(用化学符号填写):
(1)A+是______,B3+是____________,C3+是____________;
(2)X是____________,Y是____________,Z是____________;
(3)写出有关离子方程式:
①生成Y沉淀:_______________________;
②生成Z沉淀:_______________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国晋代《抱朴子》中描述了大量的化学反应,其中有:①“丹砂(HgS)烧之成水银,积变又还成丹砂”; ②“以曾青涂铁,铁赤色如铜”。下列有关叙述正确的是
A. ①中水银“积变又还成丹砂”说明水银发生了还原反应
B. ②中反应的离子方程式为:2Fe+3Cu2+=2Fe3++3Cu
C. 根据①可知温度计打破后可以用硫粉覆盖水银,防止中毒
D. 水银能跟曾青发生置换反应生成单质铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表中的一部分,
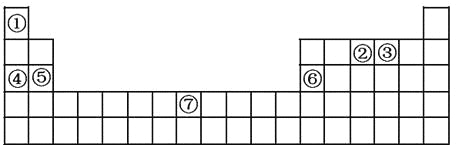
回答下列问题:
(1)画出③元素的原子结构示意图 ;在④⑤⑥三种元素中,原子半径最大的是 (用元素符号表示);⑦元素在周期表中的位置是 。
(2)④的单质在③的单质中燃烧生成甲,甲中化学键的类型为 。
(3)写出⑥的最高价氧化物与④的最高价氧化物对应水化物反应的离子方程式 。
(4)②的最简单气态氢化物与其最高价含氧酸可发生化合反应生成乙,用离子方程式表示乙的水溶液显酸性的原因 。
(5)丙是⑤的最高价氧化物对应的水化物,难溶于水。在298K时,丙的Ksp=5.6×10—12,则pH=13.0的丙的饱和溶液中,⑤离子的物质的量浓度为 。
(6)向含元素⑦的某硫酸盐(丁)溶液中加入足量的浓NaOH溶液,生成无色有刺激性气味的气体,同时产生白色沉淀,很快变成灰绿色,最后变成红褐色。写出丁的化学式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化工生产的叙述中,符合目前工业生产实际的是( )
A.石油工业中,采用干馏的方法把石油分成不同沸点范围的产品
B.硝酸工业中,为了加快氨氧化的速率,通常使用铁触媒作催化剂
C.纯碱工业中,氨碱法通过氨气和二氧化碳的循环利用,提高了原料的利用率
D.合成氨工业中,采用高压条件,增大合成氨反应的平衡常数,增大原料转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是:( )
A.在100℃、101kpa条件下,液态水的气化热为40.69kJ/mol,则H2O(g) ![]() H2O(l)的△H=40.69kJ/mol
H2O(l)的△H=40.69kJ/mol
B.已知MgCO3的Ksp=6.82×10-6,则所有含有固体的溶液中,都有c(Mg2+)=c(CO32-)=6.82×10-6
C.已知: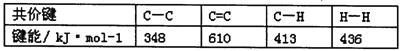 ,则可以计算出反应
,则可以计算出反应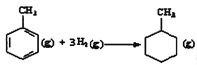 的△H为-384kJ/mol
的△H为-384kJ/mol
D.常温下,在0.10mol/L的NH3·H2O溶液中加入少量NH4Cl晶体,能使NH3·H2O的电离度降低,溶液的pH减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com