
根据所学知识回答下列问题:
(1)用离子方程式表示盐碱地(含较多Na2CO3)呈碱性的原因:____________;相同浓度的Na2CO3溶液与NaHCO3溶液等体积混合后,溶液中c(HCO3-) ____c(CO32-)(用“>、<、=”表示)。
(2)常温时,AlCl3溶液呈____性(填“酸”、“碱”或“中”),将AlCl3溶液蒸干,灼烧,得到的固体产物是________。AlCl3溶液和NaHCO3溶液混合时发生反应的离子方程式为____________________。
科目:高中化学 来源:2015-2016学年四川省成都市高二下4月月考化学试卷(解析版) 题型:选择题
下列有关晶体的叙述中,错误的是( )
A.金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子
B.氯化钠晶体中,每个Na+周围距离相等且最近的Na+共有6个
C.金属晶体中,以“…ABCABCABC…”形式的堆积称为面心立方堆积
D.干冰晶体中,每个CO2分子周围距离相等且最近的CO2分子共有12个
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西大学附中高二下3月月考化学试卷(解析版) 题型:选择题
下列分子中,属于非极性分子的是( )
A.SO2 B.BeCl2 C.CH3Cl D.COCl2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西重点中学协作体高二下学期期末化学试卷(解析版) 题型:选择题
下列各组中两个变化所发生的反应,属于同一类型的是( )
A.由氯乙烷制乙烯、由溴乙烷制乙醇
B.乙烯使溴的CCl4溶液褪色、甲苯使酸性高锰酸钾水溶液褪色
C.由HO-CH2-COOH制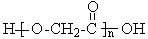 、由氯乙烯制聚氯乙烯
、由氯乙烯制聚氯乙烯
D.由苯制硝基苯、由乙醇制取乙酸乙酯
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省资阳市高二下学期期末化学试卷(解析版) 题型:实验题
某同学用中和滴定的方法测定混有少量Na2CO3的NaOH固体中NaOH的含量,准确称取2.0 g样品配制成200 mL溶液,然后分三次各取20.00 mL溶液于三个洁净的锥形瓶中,分别加入过量BaCl2溶液和1~2滴指示剂,用浓度为0.2000 mol·L-1的盐酸标准液进行滴定。
(1)滴定时应选用____作指示剂;到达滴定终点的实验现象是____。
(2)下列操作会导致烧碱样品中NaOH含量测定值偏高的是____。
A.锥形瓶未用待测液润洗 |
B.酸式滴定管未用标准液润洗 |
C.在滴定前有气泡,滴定后气泡消失 |
D.滴定前平视读数,滴定结束俯视读数 |
E.滴定终点前加水清洗锥形瓶
F.指示剂变色后立即读数
(3)实验相关数据记录如下:
实验编号 | V(烧碱溶液)/mL | V(HCl)/mL | |
初读数 | 末读数 | ||
1 | 20.00 | 0.60 | 20.62 |
2 | 20.00 | 0.80 | 20.78 |
3 | 20.00 | 0.20 | 20.90 |
依据表中数据,计算样品中NaOH的质量分数____。
查看答案和解析>>
科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(天津卷精编版) 题型:实验题
水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg/L,我国《地表水环境质量标准》规定,生活饮用水源的DO不能低于5mg/L。某化学小组同学设计了下列装置(夹持装置略),测定某河水的DO。
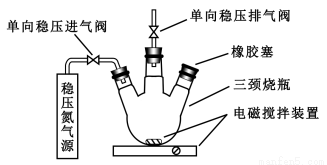
1、测定原理:
碱性条件下,O2将Mn2+氧化为MnO(OH)2:①2Mn2++O2+4OH?=2 MnO(OH)2↓
酸性条件下,MnO(OH)2将I?氧化为I2:②MnO(OH)2+I?+H+→Mn2++I2+H2O(未配平),用Na2S2O3标准溶液滴定生成的I2:③2S2O32?+I2=S4O62?+2I?
2、测定步骤
a.安装装置,检验气密性,充N2排尽空气后,停止充N2。
b.向烧瓶中加入200mL水样。
c.向烧瓶中依次迅速加入1mLMnSO4无氧溶液(过量)、2mL碱性KI无氧溶液(过量),开启搅拌器,至反应①完全。
d搅拌并向烧瓶中加入2mL硫酸无氧溶液至反应②完全,溶液为中性或弱酸性。
e.从烧瓶中取出40.00mL溶液,以淀粉作指示剂,用0.01000mol/L Na2S2O3溶液进行滴定,记录数据。
f.……
g.处理数据(忽略氧气从水样中的逸出量和加入试剂后水样体积的变化)。
回答下列问题:
(1)配置以上无氧溶液时,除去所用溶剂水中氧的简单操作为__________。
(2)在橡胶塞处加入水样及有关试剂应选择的仪器为__________。
①滴定管②注射器③量筒
(3)搅拌的作用是__________。
(4)配平反应②的方程式,其化学计量数依次为__________。
(5)步骤f为__________。
(6)步骤e中达到滴定终点的标志为__________。若某次滴定消耗Na2S2O3溶液4.50mL,水样的DO=__________mg/L(保留一位小数)。作为饮用水源,此次测得DO是否达标:__________(填“是”或“否”)
(7)步骤d中加入硫酸溶液反应后,若溶液pH过低,滴定时会产生明显的误差,写出产生此误差的原因(用离子方程式表示,至少写出2个)__________。
查看答案和解析>>
科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(天津卷精编版) 题型:选择题
下列对氨基酸和蛋白质的描述正确的是( )
A.蛋白质水解的最终产物是氨基酸
B.氨基酸和蛋白质遇重金属离子均会变性
C.α-氨基丙酸与α-氨基苯丙酸混合物脱水成肽,只生成2种二肽
D.氨基酸溶于过量氢氧化钠溶液中生成的离子,在电场作用下向负极移动
查看答案和解析>>
科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(新课标3卷精编版) 题型:填空题
煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。回答下列问题:
(1) NaClO2的化学名称为_______。
(2)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×10?3mol·L?1。反应一段时间后溶液中离子浓度的分析结果如下表。
离子 | SO42? | SO32? | NO3? | NO2? | Cl? |
c/(mol·L?1) | 8.35×10?4 | 6.87×10?6 | 1.5×10?4 | 1.2×10?5 | 3.4×10?3 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式__________。增加压强,NO的转化率______(填“提高”、“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐______ (填“增大”“不变”或“减小”)。
③由实验结果可知,脱硫反应速率______脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___________。
(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压pe如图所示。
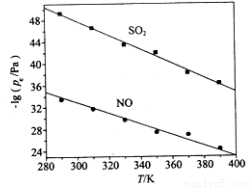
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均______________(填“增大”、“不变”或“减小”)。
②反应ClO2?+2SO32?===2SO42?+Cl?的平衡常数K表达式为___________。
(4)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。
①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是_______。
②已知下列反应:
SO2(g)+2OH? (aq) ===SO32? (aq)+H2O(l) ΔH1
ClO? (aq)+SO32? (aq) ===SO42? (aq)+Cl? (aq) ΔH2
CaSO4(s) ===Ca2+(aq)+SO42?(aq)ΔH3
则反应SO2(g)+ Ca2+(aq)+ ClO? (aq) +2OH? (aq) === CaSO4(s) +H2O(l) +Cl? (aq)的ΔH=______。
查看答案和解析>>
科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(海南卷精编版) 题型:填空题
顺-1,2-二甲基环丙烷和反-1,2-二甲基环丙烷可发生如下转化:
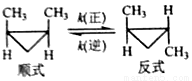
该反应的速率方程可表示为:v(正)=k(正)c(顺)和v(逆)=k(逆)c(反),k(正)和k(逆)在一定温度时为常数,分别称作正,逆反应速率常数。回答下列问题:
(1)已知:t1温度下,k(正)=0.006s-1,k(逆)=0.002s-1,该温度下反应的平衡常数值K1=_____;该反应的活化能Ea(正)小于Ea(逆),则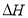 ________0(填“小于”“等于”或“大于”)。
________0(填“小于”“等于”或“大于”)。
(2)t2温度下,图中能表示顺式异构体的质量分数随时间变化的曲线是_______(填曲线编号),平衡常数值K2=_____;温度t2___t1(填“小于”“等于”或“大于”),判断理由是______。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com