
【题目】铁及其化合物在生产、生活中应用广泛,研究铁及其化合物的应用意义重大。
(1)绿矾是一种重要的硫酸盐,其化学式为FeSO4·7H2O,某化学兴趣小组通过实验探究来测定某绿矾样品中FeSO4·7H2O的含量,步骤如下:
i.称取上述样品9.0g,配成250 mL准确浓度的FeSO4溶液;
ii.最取25.00 mL上述溶液于锥形瓶中,用0.02000 mol·L-1的酸性KMnO4溶液与之完全反应,消耗KMnO4溶液30.00 mL(杂质不与KMnO4溶液反应)。
①配制FeSO4溶液时,需要用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、量筒、___;配制溶液过程中未洗涤烧杯、玻璃棒,会造成所配溶液浓度____(填“偏大”、“偏小”或“无影响”)。
②步骤ii中反应的离子方程式为5Fe2++MnO4-+X=5Fe3++Mn2++4H2O,则X的化学式为______,其系数为______。
③该样品中FeSO4·7H2O的质量百分含量为____(计算结果保留1位小数)。
(2)工业上用氯化铁腐蚀铜箔制造电路板。某工程师为了从使用过的腐蚀废液中回收铜,并获得氯化铁溶液,准备采用下列步骤:
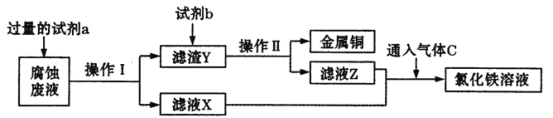
回答下列问题:
①请写出试剂a的化学式____,试剂b的名称____。
②滤液X、Z中均含有同一种溶质,它们转化为氯化铁溶液的离子方程式为________。
【答案】250mL容量瓶 偏小 H+ 8 92.7% Fe 盐酸 2Fe2+ + Cl2 = 2Fe3+ + 2Cl-
【解析】
⑴①配成250 mL准确浓度的FeSO4溶液,需要用到的玻璃仪器,再根据公式进行误差分析;②根据质量守恒和电荷守恒得到X的化学式和系数;③根据方程式得到关系式5FeSO4·7H2O — KMnO4,先计算物质的量,再计算百分含量。
⑵①氯化铁腐蚀铜箔制造电路板得到FeCl2、CuCl2,将铜置换出来,则要加入过量Fe,滤渣Y主要是Cu、Fe,将Fe除掉,加入盐酸;②滤液FeCl2与Cl2反应生成FeCl3。
⑴①配成250 mL准确浓度的FeSO4溶液,需要用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、量筒、250mL容量瓶;配制溶液过程中未洗涤烧杯、玻璃棒,溶质质量减少,因此会造成所配溶液浓度偏小;故答案为:250mL容量瓶;偏小。
②步骤ii中反应的离子方程式为5Fe2++MnO4-+X=5Fe3++Mn2++4H2O,根据质量守恒和电荷守恒得到X的化学式为H+,其系数为8。
③根据方程式得到关系式5FeSO4·7H2O — KMnO4,25.00 mL上述溶液n(Fe2+)= 0.02000 mol·L-1×0.03L ×5= 3×103mol,则9.0g样品中n(FeSO4·7H2O)= n(Fe2+)= 3×103mol×10 = 3×102mol,该样品中FeSO4·7H2O的质量百分含量![]() ;故答案为:92.7%。
;故答案为:92.7%。
⑵①氯化铁腐蚀铜箔制造电路板得到FeCl2、CuCl2,将铜置换出来,则要加入过量Fe,因此试剂a的化学式Fe,滤渣Y主要是Cu、Fe,将Fe除掉,加入盐酸,Fe反应,Cu不反应,因此试剂b的名称盐酸;故答案为:Fe;盐酸。
②滤液X、Z中均含有同一种溶质,FeCl2与Cl2反应生成FeCl3,因此转化为氯化铁溶液的离子方程式为2Fe2+ + Cl2 = 2Fe3+ + 2Cl-;故答案为:2Fe2+ + Cl2 = 2Fe3+ + 2Cl-。


科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为2.0L的恒容密闭容器中分别加入一定量的X,发生反应:pX(g) ![]() Y(g)+Z(g),相关数据如下表所示:
Y(g)+Z(g),相关数据如下表所示:
容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
X(g) | Y(g) | Z(g) | ||
Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | 0.160 | 0.160 |
Ⅲ | T | 0.20 | 0.090 | 0.090 |
回答下列问题:
(1)若容器Ⅰ中反应经10min达到平衡,则前10min内Y的平均反应速率v(Y)=___________。容器Ⅰ和容器Ⅱ中起始时X的反应速率v(X)Ⅰ___________v(X)Ⅱ(填“大于”“小于”或“等于”)。
(2)已知该正反应为放热反应,则T___________387(填“大于”或“小于”),判断理由是___________。
(3)反应方程式中X的化学计量数p的取值为___________,容器Ⅱ中X的平衡转化率为___________。若起始时向容器Ⅰ中充入0.1molX、0.15molY和0.10molZ,则反应将向___________ (填“正”或“逆”)反应方向进行,判断理由是_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子工业常用 30%的 FeCl3 溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)在加入①物质的过程中通常不断搅拌,搅拌的目的是_____。
(2)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得纯净的 FeCl3 溶液,准备采用下列步骤:

请写出上述实验中加入或生成的有关物质的化学式:①________,④____。
(3)要证明某溶液中不含 Fe3+而可能含有 Fe2+,进行如下实验操作时的最佳顺序为__________。
①加入足量氯水 ②加入足量KMnO4 溶液 ③加入少量KSCN 溶液
A.①③ B.③② C.③① D.①②③
(4)写出向②⑤的混合液中通入⑥的离子方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写及评价,均合理的是
选项 | 离子方程式 | 评价 |
A | 用铜电极电解饱和KCl溶液:2H2O+2Cl- | 正确:Cl-的失电子能力比OH-强 |
B | 向CuSO4溶液中通入过量的H2S气体:Cu2++H2S=CuS↓+2H+ | 错误:H2S的酸性比H2SO4弱 |
C | Ba(HCO3)2溶液与足量的NaOH溶液反应:Ba2++HCO3- +OH- ═BaCO3↓+H2O | 错误:Ba2+与HCO3-系数比应为1:2 |
D | 过量SO2通入到NaClO溶液中:SO2+ClO- +H2O= HClO+HSO3- | 正确:H2SO3的酸性比HClO强 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室中硫酸试剂瓶标签上的部分内容。据此分析下列说法正确的是
硫酸 化学纯
500mL
品名:硫酸
化学式:H2SO4
相对分子质量:98
密度:1.84g·cm-3
质量分数:98%
A.该硫酸的物质的A浓度为9.2 mol·L-1
B.配制500 mL 4.6 mol·L-1的稀硫酸,需要量取125mL该硫酸
C.标准状况下,1 mol Fe与足量的该硫酸反应,产生22.4L的气体
D.该硫酸与等体积的水混合后,所得溶液的质量分数等于49%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见有机物A、B、C、D、E、G间的转化关系如下图所示(以下变化中,某些反应条件及产物未标明)。B是天然有机高分子化合物,C、D可发生银镜反应,在相同条件下,G蒸气密度是氦气的22倍。

(1)B的分子式为_____、G、的结构简式为_____。
(2)E中官能团的名称_____。
(3)A的同分异构体的结构简式_____。
(4)A→D反应的化学方程式:_____、其反应类型是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学实验兴趣小组为了证明在实验室制备Cl2的过程中会有水蒸气和HCl挥发出来,甲同学根据下列仪器设计实验装置证明上述结论。请按要求回答问题。

(1)U形接管中所盛试剂的化学式为_______________。
(2)检验产物中HCl 的离子方程式:____________________。
(3)乙同学认为甲同学的实验有缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加装置⑤。你认为装置⑤应加在________________之间(填装置序号)瓶中可以放入_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标号为①-⑩的元素,在元素周期表中的位置如下:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
1 | ① | ② | ||||||
2 | ③ | ④ | ⑤ | ⑥ | ||||
3 | ⑦ | ⑧ | ⑨ | ⑩ |
试回答下列问题:
(1)②号元素是______![]() 填元素符号
填元素符号![]() ,⑨号元素的离子结构示意图为______
,⑨号元素的离子结构示意图为______
![]() 任写两种
任写两种![]() 。
。
(3)用电子式表示①④号元素形成的最简单化合物的形成过程______
(4)③的最高价氧化物与⑧的单质在点燃条件下发生反应的化学方程式______
(5)①、⑤、⑦号元素形成的化合物的电子式是______,该化合物所含化学键的类型为______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com