
常温下,下列溶液中有关微粒的物质的量浓度关系正确的是
A.0.1 mol·L-1 (NH4)2Fe(SO4)2溶液:c(SO42-)>c( )>c(Fe2+)>c(H+)
)>c(Fe2+)>c(H+)
B.0.1 mol·L-1 NaHCO3溶液:c(Na+)+c(H+)=c( )+c(
)+c(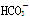 )+c(OH-)
)+c(OH-)
C.0.1 mol·L-1Na2S溶液:2c(Na+) =c(S2-)+c(HS-) +c(H2S)
D.0.01 mol·L-1NaOH溶液与等体积pH=2的醋酸混合后的溶液:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
AD
【解析】
试题分析:A、0.1 mol·L-1 (NH4)2Fe(SO4)2溶液铵根离子、亚铁离子均水解,溶液显酸性,则c(SO42-)>c(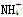 )>c(Fe2+)>c(H+),A正确;B、0.1 mol·L-1 NaHCO3溶液中,根据电荷守恒可知c(Na+)+c(H+)=2c(
)>c(Fe2+)>c(H+),A正确;B、0.1 mol·L-1 NaHCO3溶液中,根据电荷守恒可知c(Na+)+c(H+)=2c(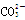 )+c(
)+c( )+c(OH-),B错误;C、0.1 mol·L-1Na2S溶液中根据物料守恒可知c(Na+)=2c(S2-)+2c(HS-) +2c(H2S),C错误;D、醋酸是弱酸,pH=2的醋酸溶液的浓度大于0.01mol/L,实验0.01 mol·L-1NaOH溶液与等体积pH=2的醋酸混合后产生过量,溶液显酸性,则c (CH3COO-) >c (Na+) > c (H+)> c (OH-),D正确,答案选AD。
)+c(OH-),B错误;C、0.1 mol·L-1Na2S溶液中根据物料守恒可知c(Na+)=2c(S2-)+2c(HS-) +2c(H2S),C错误;D、醋酸是弱酸,pH=2的醋酸溶液的浓度大于0.01mol/L,实验0.01 mol·L-1NaOH溶液与等体积pH=2的醋酸混合后产生过量,溶液显酸性,则c (CH3COO-) >c (Na+) > c (H+)> c (OH-),D正确,答案选AD。
考点:考查溶液中离子浓度大小比较


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源:2014-2015学年山东省潍坊市高三上学期期中考试化学试卷(解析版) 题型:填空题
(14分)金属铜具有良好的导电性和导热性,在电气和电子工业中应用广泛。请回答下列问题:
(1)资料显示:加热条件下氨气能够还原CuO得到金属铜。某同学用装置I和Ⅱ制取纯净干燥的氨气,装置I中应选用试剂______(供选用的试剂有:NH4Cl固体、NH4HCO3固体),试剂a最好选用__________,其作用是_________________________________________;装置III吸收尾气,如何检验所得溶液中数目最多的阳离子(只回答试剂名称和实验现象)_____________________。

(2)电解硫酸铜溶液也可得到金属铜。
①以黄铜矿(主要成份为CuFeS2)为原料采用电解法可制取硫酸铜溶液。实验室用如图所示装置模拟其过程,阳极区稀硫酸的作用是溶解矿粉得到Cu2+、Fe2+、H2S,硫酸铁的作用是氧化吸收H2S,防止逸出造成污染。电解过程中,阳极区Fe3+的浓度基本保持不变,原因是(用电极反应式回答)______________,阴极上先有固体析出,然后又溶解,阴极区通入O2的作用是(用离子方程式回答)__________________。

②用惰性电极电解一定浓度CuSO4溶液制取金属铜,一段时间后停止通电,此时加入9.8gCu(OH)2恰好能使电解质溶液恢复至初始状态,则该过程中阳极产生气体的体积为____________L(标准状况)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省盐城市高三第二次调研考试化学试卷(解析版) 题型:选择题
化学与社会、生产、生活紧切相关。下列说法正确的是
A.为了增加食物的营养成分,可以大量使用食品添加剂
B.高纯硅及其氧化物在太阳能电池及信息高速传输中有重要应用
C.石英只能用于生产光导纤维
D.从海水中提取物质都必须通过化学反应才能实现
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省无锡市高三期中化学试卷(解析版) 题型:选择题
用下列实验装置进行相应的实验,能达到实验目的的是

A.图I所示装置制取干燥的氨气
B.图II所示装置用于提取I2的CCl4溶液中的I2
C.图III所示装置微热稀HNO3,在广口瓶中可收集NO气体
D.图IV所示装置可用于除去CO2中含有的少量HCl
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省宿迁市高三上学期第一次摸底考试化学试卷(解析版) 题型:实验题
(15分)硫酸工业产生的废气A(主要成分:SO2、O2、N2、CO2等)排放到空气中会污染环境。某化学兴趣小组对废气A的组成进行探究,请回答下列问题。
(1)同学甲设计实验检验废气A中含有的CO2,应选择的试剂有 。
A.NaOH溶液 B.酸性KMnO4溶液 C.澄清石灰水 D.盐酸
(2)同学乙欲测定废气A中SO2的含量,取a L废气A并设计了如下装置进行实验。
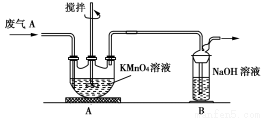
①为了保证实验成功,装置A应具有的现象是 ,搅拌的目的是 。
②同学丙认为A装置前后的质量差就是a L废气中含有的SO2的质量,然后进行含量计算。经小组讨论后,同学丁提出疑问,按照同学丙的实验,若废气中SO2完全被吸收,则最后测定的结果应该偏大,同学丁推断的理由是 。
(3)兴趣小组的同学查阅资料发现可利用硫酸工业废气A制备皓矾(ZnSO4?7H2O)。实验模拟制备皓矾工业流程如下:

①“氧化”中加入硫酸铁发生反应的离子方程式是 。
②加入Zn粉的目的是 。
③固体A主要成分是 。
④操作b得到纯净皓矾晶体,必要的操作是 、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省宿迁市高三上学期第一次摸底考试化学试卷(解析版) 题型:选择题
短周期主族元素X、Y、Z、W的原子序数依次递增。X的原子核中无中子;Y原子最外层电子数是内层的2倍;Z、W为同族元素,形成的WZ2分子是酸雨的主要成因。下列说法中正确的是
A.X与Y形成原子个数比为1∶1的化合物只有两种
B.Y、W的氧化物均为酸性氧化物
C.最高价氧化物对应水化物的酸性Y<W
D.X与Z形成的化合物中,各原子均满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省宿迁市高三上学期第一次摸底考试化学试卷(解析版) 题型:选择题
下列有关化学用语的表示正确的是
A.N2的电子式: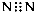
B.CH4的比例模型:
C.中子数为45的溴原子:45 35Br
D.对羟基苯甲酸的结构简式:
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省连云港市高三上学期期中化学试卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数的值,下列说法中正确的是
A.6.72 L Cl2与足量的水反应转移的电子数为0.3NA
B.1 L 0.5 mol·L-1的氨水中所含的离子和分子总数为0.5NA
C.常温常压下,4.6g NO2和N2O4混合物中含有的原子总数为0.3 NA
D.在反应KIO3+6HI =KI+3I2+3H2O中,每生成3mol I2转移的电子数为6NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年重庆复旦中学高二上学期期中化学试卷(解析版) 题型:选择题
把镁条投入到盛有盐酸的敞口容器中,产生H2的速率可
由如图表示,在下列因素中,①盐酸的浓度,②镁条的表面积,③溶液的温度,④氯离子的浓度,

影响反应速率的因素是
A.①④ B.③④ C.①②③ D.②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com