
| A. | pH=6的纯水中,c(OH-)=10-8 mol•L-1 | |
| B. | 向0.1 mol•L-1Na2SO3溶液中加入少量NaOH固体,c(Na+)、c(SO32-)均增大 | |
| C. | 室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后溶液pH>7 | |
| D. | 0.1 mol•L-1Na2CO3溶液中c(OH-)=c(H+)+c(HCO3-)+c(H2CO3) |
分析 A.由水电离出的氢离子浓度等于由水电离出的氢氧根离子浓度;
B.亚硫酸钠溶液中加入氢氧化钠,钠离子浓度增大,氢氧根离子浓度增大抑制了亚硫酸根离子的水解,导致亚硫酸根离子浓度也增大;
C.醋酸为弱酸,不能完全电离,pH值为3的CH3COOH和pH为11的NaOH溶液,两溶液中c(OH-)和c(H+)相等,反应后酸过量,溶液呈酸性;
D.由水电离出的氢离子浓度等于由水电离出的氢氧根离子浓度,据此判断即可.
解答 解:A.pH=6的纯水中,氢离子浓度等于氢氧根离子浓度,均为10-6 mol•L-1,故A错误;
B.向0.1mol/LNa2SO3溶液中加入少量NaOH固体,溶液中钠离子、氢氧根离子浓度增大,氢氧根离子抑制了亚硫酸根离子的水解,则亚硫酸根离子浓度增大,所以c(Na+)、c(SO32-)均增大,故B正确;
C.pH值为3的CH3COOH和pH为11的NaOH溶液,两溶液中c(OH-)和c(H+)相等,都为0.001mol/L,但醋酸为弱酸,不能完全电离,所以醋酸浓度大,反应后酸过量,则混合溶液呈酸性,pH<7,故C错误;
D.由水电离出的氢离子浓度等于由水电离出的氢氧根离子浓度,0.1 mol•L-1Na2CO3溶液中存在:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),故D错误,
故选B.
点评 本题考查了离子浓度大小比较,题目难度不大,明确物料守恒的含义为解答关键,注意掌握守恒思想在化学计算中的应用,试题侧重基础知识的考查,培养了学生的灵活应用能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
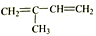 ⑤
⑤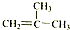 ⑥CH3CH(C2H5)CH2CH(C2H5)CH3 ⑦C5H10 ⑧ClCH=CHCl ⑨C5H4
⑥CH3CH(C2H5)CH2CH(C2H5)CH3 ⑦C5H10 ⑧ClCH=CHCl ⑨C5H4 .
. .
. .
.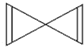 D.
D.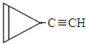 e.
e.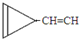 …
… 或
或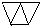 (只需答出一例的结构简式).
(只需答出一例的结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2中混有CO (炽热的炭) | B. | NaOH溶液中混有Ba(OH)2(CuSO4) | ||
| C. | CO2中混有HCl气体 (NaOH溶液) | D. | Cu(NO3)2中混有AgNO3(Cu粉) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示,在盛有水的烧杯中倒置一支试管,底部有一枚铁钉,放置数天后观察:
如图所示,在盛有水的烧杯中倒置一支试管,底部有一枚铁钉,放置数天后观察:| A. | 铁钉生锈,铁钉的腐蚀属于电化学腐蚀腐蚀 | |
| B. | 若试管内液面上升,则铁钉发生的是吸氧腐蚀 | |
| C. | 若试管内液面上升,则铁钉发生的是析氢腐蚀 | |
| D. | 若试管内液面下降,则铁钉发生的是析氢腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Fe3++Fe═3Fe2+成立,说明氧化性:Fe3+>Fe2+ | |
| B. | SO2饱和溶液中NH4+、K+、CO32-、SO32-可大量存在 | |
| C. | 用NaOH溶液吸收尾气中的氯气:Cl2+4OH-═2ClO-+2H2O | |
| D. | 向NaHS溶液中加入适量硝酸发生反应:HS-+H+═H2S↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 用品 | 水玻璃 | “84”消毒液 | 食用纯碱 | 复方氢氧化铝片 |
| 主要成分 | Na2SiO3 | NaClO | NaHCO3 | Al(OH)3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤时,用玻璃棒搅动滤纸中的液体 | |
| B. | 向试管中滴加液体时,胶头滴管紧贴试管内壁 | |
| C. | 加热试管内物质时,试管底部与酒精灯灯芯接触 | |
| D. | 用自来水制蒸馏水时,弃去开始馏出的部分液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1=-57.3kJ/mol是强酸和强碱在稀溶液中反应生成可溶性盐的中和热 | |
| B. | 在氢氧化钠溶液与盐酸的反应中,盐酸量一定,氢氧化钠溶液量越多,中和热越大 | |
| C. | HF的电离方程式及热效应:HF(aq)?H+(aq)+F-(aq)△H>0 | |
| D. | 稀硫酸与稀氢氧化钡溶液反应的热化学方程式为H2SO4(aq)+Ba(OH)2(aq)═BaSO4(s)+2H2O(l)△H=-114.6kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com