
【题目】在AlCl3和MgCl2的混合溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH溶被的体积和所得沉淀的物质的量的关系如图所示(b处NaOH溶液的体积为2L),则下列判断正确的是
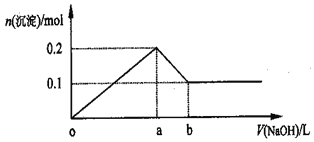
A. NaOH溶液的物质的量浓度为0.5mol/L
B. 混合溶液中A13+与Mg2+物质的量之比为2:1
C. a点时消耗NaOH溶液的体积与b点时消耗NaOH溶液的体积之比为5:1
D. 在b处溶液中的溶质只有Na[Al(OH)4]
【答案】C
【解析】分析:AlCl3和MgCl2的混合溶液中,逐滴加入NaOH溶液,发生反应生成氢氧化铝、氢氧化镁沉淀,加入aLNaOH溶液时,沉淀达最大值共0.2mol,此时溶液为NaCl溶液,继续滴加NaOH溶液直至过量,氢氧化铝与NaOH反应逐渐溶解,在bL时,即再继续滴加NaOH溶液(b-a)L时,氢氧化铝完全溶解,沉淀为氢氧化镁0.1mol,溶液为NaCl、NaAlO2溶液。
详解:A.在bL时,溶液为NaCl、NaAlO2溶液,由图象可知:n[Al(OH)3]=0.1mol,n(Mg(OH)2]=0.1mol,根据Mg原子守恒有n(MgCl2)=n(Mg(OH)2]=0.1mol,根据Al原子守恒有n(NaAlO2)=n(AlCl3)=n[Al(OH)3]=0.1mol,由Cl原子守恒有n(Cl)=n(NaCl)=2n(MgCl2)+3n(AlCl3)=2×0.1mol+3×0.1mol=0.5mol,由Na原子守恒有n(NaOH)=n(NaCl)+n(NaAlO2)=0.5mol+0.1mol=0.6mol,所以c(NaOH)=0.6mol÷2L=0.3mol/L,A错误;
B.由以上分析可知,溶液中n(MgCl2)=n[(Mg(OH)2]=0.1mol,n(AlCl3)=n[Al(OH)3]=0.1mol,即溶液中的混合溶液中n(Al3+):n(Mg2+)=1:1,B错误;
C.加入aLNaOH溶液时,沉淀达最大值共0.2mol,由反应方程式可知,此时溶液为NaCl溶液,在bL时,即再继续滴加NaOH溶液(b-a)L时,氢氧化铝与NaOH恰好反应,氢氧化铝完全溶解,沉淀为氢氧化镁0.1mol,溶液为NaCl、NaAlO2溶液,所以两部分NaOH溶液的体积之比等于消耗的NaOH的物质的量之比,即为n(NaCl)与n(NaAlO2)之比,故oa:ab=a:(b-a)=0.5mol:0.1mol=5:1,C正确;
D.加入bLNaOH溶液时,沉淀0.1mol,为氢氧化铝溶解完毕,此时溶液为Na[Al(OH)4]、NaCl混合物,D错误;答案选C。


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
【题目】能用离子方程式H++OH-=H2O表示的化学反应是( )
A.氨水和稀盐酸反应B.Ba(OH)2溶液和稀硫酸反应
C.KOH溶液和稀盐酸反应D.KOH溶液和CO2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在CH3COOH溶液中存在如下平衡:CH3COOHCH3COO﹣+H+ . 加入少量下列物质或采取下述方法,能使平衡逆向移动的是( )
A.加水
B.CH3COONa固体
C.升温
D.NaCl固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是
A. 标准状况下,5.6L.Cl2与足量NaOH反应转移的电子数为0.25NA
B. 室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
C. 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA
D. 5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成56gN2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成56gN2时,转移的电子数目为3.75NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】看图回答下列问题 
(1)若烧杯中溶液为稀硫酸,则观察到的现象是 , 电流表指针(填偏转或不偏转),两极反应式为:正极;负极 .
(2)若烧杯中溶液为氢氧化钠溶液,则负极为(填Mg或Al),总反应方程式为
(3)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如图所示:A、B两个电极均由多孔的碳块组成.该电池的正极反应式为: .
(4)如果将上述装置中通入的H2改成CH4气体,也可以组成一个原电 池装置,电池的总反应方程式为:CH4+2O2+2KOH=K2CO3+3H2O,则该电池的负极反应式为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.元素周期表的一部分如下表所示,参照元素①~⑩在表中的位置,请回答下列问题:

(1)⑨的阴离子结构示意图为_____________________;③的简单氢化物与⑨的最高价氧化物对应的水化物化合生成的正盐的化学式为______________________。
(2)⑤和⑥形成的化合物的电子式为________________________。
(3)③、⑧的最高价氧化物对应水化物的酸性由强到弱的顺序为___________(用化学式表示,下同)>_________________________。
II.某同学欲利用下图装置验证同周期或同主族元素性质递变规律。

(4)干燥管D的作用是_________________________________________。
(5)证明非金属性:Cl>I。在A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液变蓝,则C试管中发生反应的离子方程式为_________________________________________。从环境保护的观点考虑,此装置的缺点是_____________________________________________________。
(6)证明非金属性:N>C,在A中加稀硝酸,B中加碳酸钙,C中加澄清石灰水;观察到C中溶液变浑浊的现象,该实验设计的原理是利用____________来比较元素非金属性的强弱。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化锡常温下是无色液体,在空气中极易水解,熔点-36℃,沸点114℃,金属锡的熔点为231℃。分液漏斗中放浓盐酸,仪器a中放MnO2,二者用于制氯气,用熔融的金属锡跟干燥的氯气直接作用制取无水四氯化锡(此反应过程放出大量的热)。请回答下列各问题。
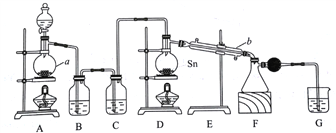
(1)仪器a、b的名称分别是______、________,仪器b的作用是__________________。
(2)图中装置F与装置G之间连接干燥管的目的是______________________________。
(3)装置D中Sn发生反应的化学方程式为___________;装 置 G 的作用是____________。
(4)装置B中的试剂是______________________;装置C的作用是_________________。
(5)实验过程中。当观察到________时,即可熄灭装置D处的酒精灯。
(6)已知四氯化锡遇水强烈水解,产物之一是固态二氧化锡,请写出四氯化锡水解的化学方程式______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究小组发现一种化合物在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算反应4 min~8 min间的平均反应速率和推测反应16 min时反应物的浓度,结果应是( )

A. 2.5 μmol·L-1·min-1和2.0 μmol·L-1
B. 2.5 μmol·L-1·min-1和2.5 μmol·L-1
C. 3.0 μmol·L-1·min-1和3.0 μmol·L-1
D. 5.0 μmol·L-1·min-1和3.0 μmol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com