
ЁОЬтФПЁПЯТБэЮЊдЊЫижмЦкБэЕФвЛВПЗжЁЃ
ЬМ | ЕЊ | Y | |
X | Сђ | Z |
ЛиД№ЯТСаЮЪЬтЃК
(1)XдЊЫидкжмЦкБэжаЕФЮЛжУЮЊ__ЁЃ
(2)NH3ЕФЕчзгЪНЮЊ__ЁЃ
(3)ЯТСаЪТЪЕФмЫЕУїY дЊЫиЕФЗЧН№ЪєадБШS дЊЫиЕФЗЧН№ЪєадЧПЕФЪЧ__ЁЃ
a.Y ЕЅжЪгыH2SШмвКЗДгІЃЌШмвКБфЛызЧ
b.дкбѕЛЏЛЙдЗДгІжаЃЌ1mol Y ЕЅжЪБШ1molSЕУЕчзгЖр
c.YКЭSСНдЊЫиЕФМђЕЅЧтЛЏЮяЪмШШЗжНтЃЌЧАепЕФЗжНтЮТЖШИп
(4)ГЃЮТЯТЃЌЬМгыУОаЮГЩЕФ 1 mol ЛЏКЯЮяQ гыЫЎЗДгІЃЌЩњГЩ2 mol Mg(OH)2КЭ 1 mol ЦјЬЌЬўЃЌИУЬўжаЬМЧтжЪСПБШЮЊ 9:1ЁЃаДГіЛЏКЯЮяQ гыЫЎЗДгІЕФЛЏбЇЗНГЬЪНЃК__ЁЃ
ЁОД№АИЁПЕкШ§жмЦкЂєAзх ![]() ac Mg2C3+2H2OЃН2Mg(OH)2Ё§+C3H4Ёќ
ac Mg2C3+2H2OЃН2Mg(OH)2Ё§+C3H4Ёќ
ЁОНтЮіЁП
ИљОндЊЫидкжмЦкБэжаЕФЯрЖдЮЛжУПЩжЊXЪЧSiЃЌYЪЧOЃЌZЪЧClЃЌОнДЫНтД№ЁЃ
(1)XдЊЫиЪЧЙшдЊЫиЃЌдкжмЦкБэжаЕФЮЛжУЮЊЕкШ§жмЦкЂєAзхЃЌЙЪД№АИЮЊЕкШ§жмЦкЂєAзхЃЛ
(2)NH3ЪєгкЙВМлЛЏКЯЮяЃЌЕчзгЪНЮЊ![]() ЃЌЙЪД№АИЮЊЃК
ЃЌЙЪД№АИЮЊЃК![]() ЃЛ
ЃЛ
(3)aЃЎYЕЅжЪгыH2SШмвКЗДгІЃЌШмвКБфЛызЧЃЌгЩгкЗЂЩњСЫЗДгІO2+H2S=H2O+SЃЌЙЪПЩжЊO2ЕФбѕЛЏадДѓгкSЃЌЙЪПЩЭЦВтYЕФЗЧН№ЪєадЧПгкSЃЌЙЪaЗћКЯЬтвтЃЛ
bЃЎдкбѕЛЏЛЙдЗДгІжаЃЌбѕЛЏадЁЂЛЙдадЧПШѕгыЕУЪЇЕчзгЕФФбвзГЬЖШгаЙиЃЌгыЕУЪЇЕчзгЕФЪ§СПЮоЙиЃЌЙЪbВЛЗћКЯЬтвтЃЛ
cЃЎдЊЫиЕФМђЕЅЧтЛЏЮяШШЮШЖЈадгыЗЧН№ЪєЧПШѕвЛжТЃЌМДЗЧН№ЪєаддНЧПЃЌЦфЦјЬЌЧтЛЏЮяОЭдНЮШЖЈЃЌЙЪcЗћКЯЬтвтЃЛ
ЙЪД№АИЮЊЃКacЃЛ
(4)гЩЬўжаЬМЧтжЪСПБШЮЊ9:1ЃЌПЩвдЧѓГіЬўжаЕФЬМдзгКЭЧтдзгЕФИіЪ§БШЮЊЃК12x:y=9:1ЃЌЕУГіx:y=3:4ЃЌЙЪИУЦјЬЌЬўЕФЗжзгЪНЮЊC3H4ЃЌдйНсКЯ1 mol ЬМгыУОаЮГЩЕФЛЏКЯЮягыЫЎЗДгІЃЌЩњГЩ2 mol Mg(OH)2КЭ1 molЦјЬЌЬўЃЌПЩжЊИУЛЏКЯЮяQЪЧMg2C3ЃЌЙЪЛЏКЯЮяQ гыЫЎЗДгІЕФЛЏбЇЗНГЬЪНЃКMg2C3+2H2OЃН2Mg(OH)2Ё§+C3H4ЁќЃЌЙЪД№АИЮЊЃКMg2C3+2H2OЃН2Mg(OH)2Ё§+C3H4ЁќЁЃ


 дФЖСПьГЕЯЕСаД№АИ
дФЖСПьГЕЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПНЋЙЬЬхNH4IжУгкУмБеШнЦїжаЃЌдквЛЖЈЮТЖШЯТЗЂЩњЯТСаЗДгІЃК
ЂйNH4I(s)![]() NH3(g)+HI(g)ЃЛЂк2HI(g)
NH3(g)+HI(g)ЃЛЂк2HI(g)![]() H2(g)+HI(g)
H2(g)+HI(g)
ДяЕНЦНКтЪБЃЌc(H2)=0.5molЁЄL-1ЃЌc(HI)=4molЁЄL-1ЃЌдђДЫЮТЖШЯТ,ЗДгІЂйЕФЦНКтГЃЪ§ЮЊ
A.9B.16C.20D.25
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП1LЯЁЯѕЫсКЭЯЁСђЫсЕФЛьКЯШмвКжаЃЌЯѕЫсКЭСђЫсЕФЮяжЪЕФСПХЈЖШОљЮЊ![]() ЁЃШєЯђЛьКЯвКжаМгШызуСПЕФЭЗлЃЌдђзюЖрФмШмНтЭЗлЕФжЪСПЮЊ
ЁЃШєЯђЛьКЯвКжаМгШызуСПЕФЭЗлЃЌдђзюЖрФмШмНтЭЗлЕФжЪСПЮЊ
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвдУїЗЏ![]() ЮЊдСЯжЦБИAlЁЂ
ЮЊдСЯжЦБИAlЁЂ![]() КЭ
КЭ![]() ЕФЙЄвеСїГЬШчЯТЃК
ЕФЙЄвеСїГЬШчЯТЃК
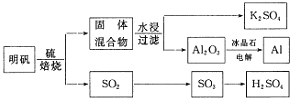
вРОнЩЯЪіСїГЬЭМЛиД№ЯТСаЮЪЬтЃК
![]() аДГіУїЗЏКЭСђЕЅжЪЛьКЯБКЩеЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪН______ЃЎ
аДГіУїЗЏКЭСђЕЅжЪЛьКЯБКЩеЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪН______ЃЎ
![]() ДгЫЎНўКѓЕФТЫвКжаЕУЕН
ДгЫЎНўКѓЕФТЫвКжаЕУЕН![]() ОЇЬхЕФЗНЗЈЪЧеєЗЂХЈЫѕЁЂ______ЁЂЙ§ТЫЃЌЪЕбщЪвдкеєЗЂХЈЫѕЙ§ГЬжагУЕНЕФжївЊвЧЦїга______ЃЎ
ОЇЬхЕФЗНЗЈЪЧеєЗЂХЈЫѕЁЂ______ЁЂЙ§ТЫЃЌЪЕбщЪвдкеєЗЂХЈЫѕЙ§ГЬжагУЕНЕФжївЊвЧЦїга______ЃЎ
![]() ЕчНт
ЕчНт![]() ЪБМгШыБљОЇЪЏЕФзїгУЪЧ______ЃЎ
ЪБМгШыБљОЇЪЏЕФзїгУЪЧ______ЃЎ
![]() вдAlКЭ
вдAlКЭ![]() ЮЊЕчМЋЃЌNaOHШмвКЮЊЕчНтвКзщГЩвЛжжаТаЭЕчГиЃЌЗХЕчЪБ
ЮЊЕчМЋЃЌNaOHШмвКЮЊЕчНтвКзщГЩвЛжжаТаЭЕчГиЃЌЗХЕчЪБ![]() зЊЛЏЮЊ
зЊЛЏЮЊ![]() ЃЌИУЕчГиЗДгІЕФЛЏбЇЗНГЬЪНЪЧ______ЃЎ
ЃЌИУЕчГиЗДгІЕФЛЏбЇЗНГЬЪНЪЧ______ЃЎ
![]() БКЩеВњЩњЕФ
БКЩеВњЩњЕФ![]() ПЩгУгкжЦСђЫсЃЎвбжЊ
ПЩгУгкжЦСђЫсЃЎвбжЊ![]() ЃЌ101kPaЪБЃК
ЃЌ101kPaЪБЃК
![]()
![]()
![]()
дђ![]() КЭ
КЭ![]() ЗДгІЕФШШЛЏбЇЗНГЬЪНЪЧ______ЃЎ
ЗДгІЕФШШЛЏбЇЗНГЬЪНЪЧ______ЃЎ
![]() БКЩе948ЖжУїЗЏ
БКЩе948ЖжУїЗЏ![]() ЃЌШє
ЃЌШє![]() ЕФРћгУТЪЮЊ
ЕФРћгУТЪЮЊ![]() ЃЌдђПЩЩњВњЖрЩйЖжжЪСПЗжЪ§ЮЊ
ЃЌдђПЩЩњВњЖрЩйЖжжЪСПЗжЪ§ЮЊ![]() ЕФСђЫсЃП
ЕФСђЫсЃП
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЮяжЪЕФзЊЛЏдкИјЖЈЬѕМўЯТВЛФмЪЕЯжЕФЪЧ( )
ЂйNa![]() Na2O2
Na2O2![]() Na2CO3
Na2CO3
ЂкMgO![]() MgCl2ШмвК
MgCl2ШмвК![]() Mg
Mg
ЂлFe![]() Fe2O3
Fe2O3![]() Fe2(SO4)3
Fe2(SO4)3
ЂмSiO2![]() Na2SiO3
Na2SiO3![]() H2SiO3
H2SiO3
ЂнHCHO![]() HCOOH
HCOOH![]() HCOOCH3
HCOOCH3
A.ЂйЂкЂлB.ЂкЂлЂмC.ЂкЂлЂнD.ЂйЂмЂн
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЛЏбЇЦНКтРрЫЦЃЌЕчРыЦНКтЕФЦНКтГЃЪ§ЃЌНазіЕчРыГЃЪ§ЃЈгУKБэЪОЃЉЁЃЯТБэЪЧФГЮТЖШЯТМИжжГЃМћШѕЫсЕФЕчРыЦНКтГЃЪ§ЃК
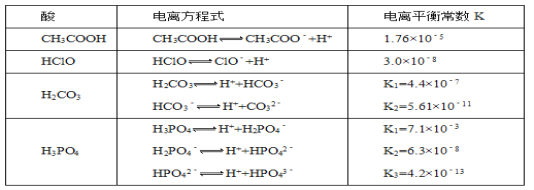
ЛиД№ЯТСаЮЪЬтЃК
(1)ШєАбCH3COOHЁЂHClOЁЂH2CO3ЁЂHCO3ЃЁЂH3PO4ЁЂH2PO4ЃЁЂHPO42ЃЖМПДзїЪЧЫсЃЌдђЫќУЧЫсадзюЧПЕФЪЧ___________ЃЈЬюЛЏбЇЪНЃЌЯТЭЌЃЉЃЌзюШѕЕФЪЧ_________________
(2)ЯђNaClOШмвКжаЭЈШыЩйСПЕФЖўбѕЛЏЬМЃЌЗЂЩњЕФРызгЗНГЬЪНЮЊ__________________________ЃЌ1.2molLЉ1ЕФNaClOШмвКpH=__________________________ЃЈвбжЊЃКlg2=0.3ЃЉЁЃ
(3)ЧѓГіИУЮТЖШЯТЃЌ0.10molLЉ1ЕФCH3COOHШмвКжаЕФc(H+)=____________molLЉ1ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдкШчЭМЫљЪОЕФКуЮТЁЂКубЙУмБеШнЦїжаМгШы2mol XКЭ2mol YЃЌЗЂЩњШчЯТЗДгІВЂДяЕНЦНКтЃЈXЁЂYзДЬЌЮДжЊЃЉЃК2X(ЃП)+Y(ЃП) ![]() a Z(g)ЁЃЦ№ЪМЪБШнЦїЕФЬхЛ§ЮЊV LЃЌДяЕНЦНКтЪБXЁЂYЁЂZЕФЮяжЪЕФСПжЎБШЮЊ1ЃК3ЃК2ЃЌЧвШнЦїЕФЬхЛ§ШдШЛЮЊV LЁЃЧыЛиД№ЯТСаЮЪЬтЃК
a Z(g)ЁЃЦ№ЪМЪБШнЦїЕФЬхЛ§ЮЊV LЃЌДяЕНЦНКтЪБXЁЂYЁЂZЕФЮяжЪЕФСПжЎБШЮЊ1ЃК3ЃК2ЃЌЧвШнЦїЕФЬхЛ§ШдШЛЮЊV LЁЃЧыЛиД№ЯТСаЮЪЬтЃК

ЃЈ1ЃЉa = _________________ЃЛ
ЃЈ2ЃЉЦНКтЪБYЕФзЊЛЏТЪ=________________
ЃЈ3ЃЉXЕФзДЬЌЮЊ______________ЃЌYЕФзДЬЌЮЊ______________ЃЈЬюЁАЦјЬЌЁБЛђЁАЗЧЦјЬЌЁБЃЉ
ЃЈ4ЃЉЯТСаа№ЪіжаЃЌФмЫЕУїЩЯЪіЗДгІДяЕНЦНКтзДЬЌЕФЪЧ____________ЃЈЬюБрКХЃЉ
aЃЎЦјЬхУмЖШВЛБф bЃЎЕЅЮЛЪБМфФкЯћКФ2mol XЃЌЭЌЪБЩњГЩamol Z
cЃЎYЕФзЊЛЏТЪВЛдйБфЛЏ dЃЎZЕФХЈЖШВЛдйБфЛЏ
eЃЎЦјЬхЕФжЪСПВЛЫцЪБМфЕФБфЛЏЖјБфЛЏ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПбаОПCO2гыCH4ЕФЗДгІЪЙжЎзЊЛЏЮЊH2КЭCOЖдМѕЛКШМСЯЮЃЛњЃЌМѕЩйЮТЪваЇгІОпгажиДѓвтвхЁЃвбжЊCH4(g)+CO2(g)Ёњ2H2(g)+2CO(g)ЁЃ
ЃЈ1ЃЉИУЗДгІЕФЦНКтГЃЪ§K=__ЁЃдк2LУмБеШнЦїжаЃЌЭЈШыCO2КЭCH4ЕФЛьКЯЦјЬхЃЌ30minКѓCH4ЕФжЪСПМѕЩйСЫ4.8gЃЌдђv(CH4)__ЁЃ
ЃЈ2ЃЉИљОнШчЭМПЩЕУГіn(CO2)ЯћКФ__n(CH4)ЯћКФЃЈЬюЁАЃОЁБЁЂЁАЃМЁБКЭЁАЃНЁБЃЌдвђЪЧ___ЁЃ

ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГОЇЬхЕФОЇАћНсЙЙЮЊе§Ш§Ртжљ(ШчЭМЫљЪО)ЃЌетжжОЇЬхжаAЁЂBЁЂCШ§жжЮЂСЃЪ§ФПжЎБШЮЊ(ЁЁЁЁ)

A. 1ЁУ4ЁУ2 B. 3ЁУ9ЁУ4
C. 2ЁУ9ЁУ4 D. 3ЁУ8ЁУ4
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com