
 第ⅤA族的氮、磷、砷(As)等元素在化合物中常表现出多种氧化态,含第ⅤA族元素的化合物在研究和生产中有许多重要用途.
第ⅤA族的氮、磷、砷(As)等元素在化合物中常表现出多种氧化态,含第ⅤA族元素的化合物在研究和生产中有许多重要用途.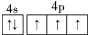 .
.分析 (1)As元素处于的第四周期VA族;
(2)N4的结构与白磷(P4)相似,每个N原子周围连有三个N原子,形成三对共用电子对,另有一个孤电子对;
(3)在NaN3固体中,阴离子为N3-,离子中有16个价电子,所以与CO2互为等电子体,根据等电子体结构相似判断;
(4)在配合物中,中心原子或离子含有空轨道,配位体含有孤对电子;
(5)①根据砷化镓晶胞的结构图,m位置Ga原子,n位置As原子,利用均摊法可知,计算晶胞中含有Ga原子、As原子数目,可以确定其化学式,As原子配位数为4,结合化学式判断镓原子的配位数;
②Ga原子与As原子之间的距离应为晶胞体对角线长度的$\frac{1}{4}$倍,所以晶胞的体对角线为晶胞棱长的$\sqrt{3}$倍.
解答 解:(1)As元素处于的第四周期VA族,所以砷的基态原子价电子排布图为 ,
,
故答案为: ;
;
(2)N4的结构与白磷(P4)相似,每个N原子周围连有三个N原子,形成三对共用电子对,另有一个孤电子对,所以N原子的轨道杂化方式为sp3,
故答案为:sp3;
(3)在NaN3固体中,阴离子为N3-,离子中有16个价电子,所以与CO2互为等电子体,根据等电子体结构相似可知,N3-的立体构型为直线形,
故答案为:直线形;
(4)在配合物中,能提供孤电子对的为配位体,所以在H[AuCl4]中,配位体是Cl-,
故答案为:Cl-;
(5)①m位置Ga原子,n位置As原子,晶胞中含有Ga原子数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,As原子数目为4,As原子配位数为4,则镓原子的配位数为4;
故答案为:GaAs;4;
②Ga原子与As原子之间的距离应为晶胞体对角线长度的$\frac{1}{4}$倍,所以晶胞的体对角线为晶胞棱长的$\sqrt{3}$倍,则m位置Ga原子与n位置As原子之间的距离为$\frac{\sqrt{3}a}{4}$pm,
故答案为:$\frac{\sqrt{3}a}{4}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、杂化方式与空间构型、配合物、晶胞计算计算等,注意N4分子的结构特点,为易错点,题目难度中等.


科目:高中化学 来源: 题型:选择题
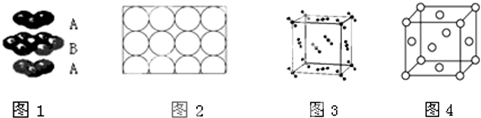
| A. | 钛和钾都采取图1的堆积方式 | |
| B. | 图2为金属原子在二维空间里的非密置层放置,此方式在三维空间里堆积,仅得简单立方堆积 | |
| C. | 图3是干冰晶体的晶胞,晶胞棱长为a cm,则在每个CO2周围最近且等距离的CO2有8个 | |
| D. | 图4是一种金属晶体的晶胞,它是金属原子在三维空间以密置层采取ABCABC…堆积的结果 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
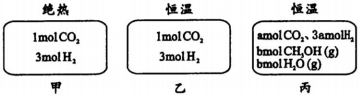
| A. | 刚开始反应时速率:甲>乙 | B. | 平衡后反应放热:甲>乙 | ||
| C. | 500℃下该反应平衡常数:K=3×102 | D. | 若a≠0,则0.9<b<l |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 实验现象 | 实验结论 |
| A | 取少量食盐溶于水,加稀硫酸酸化再滴入淀粉溶液 | 溶液呈蓝色 | 食盐为加碘食盐 |
| B | 取两支试管,都加入2mL0.01mol/L的酸性KMnO4溶液,向其中一支试管加入2mL蒸馏水后,再同时向两支试管各加入2mL0.1mol/L的H2C2O4溶液 | 两试管中溶液紫色均褪去,且后者所用时间更短 | 酸性KMnO4溶液浓度越大,化学反应速率越快 |
| C | 向蛋白质溶液中加入CuCl2或 (NH4)2SO4饱和溶液 | 均有沉淀 | 蛋白质均发生了变性 |
| D | 将0.1mol/L MgSO4溶液滴入NaOH稀溶液至不再有沉淀产生,再滴加0.1mol/L CuSO4溶液 | 白色沉淀逐渐变为蓝色沉淀 | Ksp[Cu(OH)2]<Ksp[Mg(OH)2] |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上用水吸收NO2生产硝酸:3NO2+H2O=2HNO3+NO | |
| B. | 用熟石灰处理泄漏的液氯:2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O | |
| C. | Cu与稀硝酸反应制取硝酸铜:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O | |
| D. | 用明矾除去水中的悬浮颗粒物:Al3++3H2O?Al(OH)3(胶体)+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16O→18O的转化属于化学变化 | |
| B. | 冰醋酸、消石灰、明矾、生石灰分别属于酸、碱、盐、氧化物 | |
| C. | SiO2既能与氢氟酸反应,也能与氢氧化钠溶液反应,属于两性氧化物 | |
| D. | 少量Cu将足量浓、稀硝酸分别还原为NO2和NO,其转移电子数之比为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯和水,酒精和水,苯酚和水 | |
| B. | 二溴乙烷和水,溴苯和水,硝基苯和水 | |
| C. | 乙醇和水,乙醛和水,乙酸和乙醇 | |
| D. | 油脂和水,甲苯和水,乙醇和水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com