
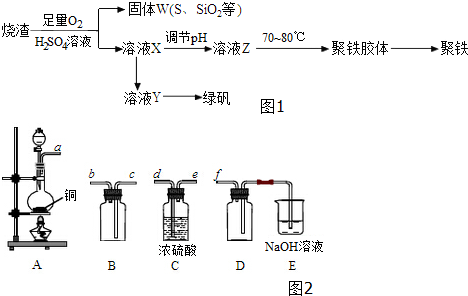
分析 制备聚铁和绿矾(FeSO4•7H2O)流程为:硫酸厂烧渣与硫酸、氧气反应,得到滤液X和不溶物(S、二氧化硅等)W;滤液X中进入铁粉生成硫酸亚铁溶液,硫酸亚铁溶液通过浓缩蒸发、冷却结晶得到绿矾;将滤液X通过调节pH获得溶液Z,在70~80℃条件下得到聚铁聚铁,最后得到聚铁,
(1)此题为二氧化硫的验证,利用其特殊性质漂白性来分析;
(2)根据实验目的连接仪器;A中铜和浓硫酸加热反应生成硫酸铜、二氧化硫和水;
(3)利用二价铁与三价铁之间的相互转化来分析;利用过滤装置分析使用的玻璃仪器;
(4)依据高锰酸钾溶液具有强氧化性分析滴定管使用;
(5)根据聚铁的化学式中铁与氢氧根离子的关系判断.
解答 解:制备聚铁和绿矾(FeSO4•7H2O)流程为:硫酸厂烧渣与硫酸、氧气反应,得到滤液X和不溶物(S、二氧化硅等)W;滤液X中进入铁粉生成硫酸亚铁溶液,硫酸亚铁溶液通过浓缩蒸发、冷却结晶得到绿矾;将滤液X通过调节pH获得溶液Z,在70~80℃条件下得到聚铁聚铁,最后得到聚铁,
(1)检验二氧化硫的一般方法是:将气体通入品红溶液中,如果品红褪色,加热后又恢复红色,证明有二氧化硫,
故答案为:将气体通入品红溶液,溶液褪色,加热恢复原色;
(2)收集二氧化硫应先干燥再收集,二氧化硫的密度比空气大,要从c口进气,最后进行尾气处理,所以按气流方向连接顺序为a→d→e→c→b→f;
装置A中铜与浓硫酸反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:d;e;c;b;Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(3)因为在烧渣中加入了硫酸和足量氧气,故溶液Y中含有Fe3+,故应先加入过量的铁粉,故答案为:铁屑;
(4)KMnO4标准溶液具有强氧化性,腐蚀橡胶管,滴定时需要选择酸式滴定管,故答案为:酸式;
(5)聚铁的化学式为Fe2(OH)n(SO4)3-0.5n,若溶液Z的pH偏小,则聚铁中生成的氢氧根的含量减少,据此计算的铁的含量减少,铁的质量分数偏小,
故答案为:偏小.
点评 本题考查了化学物质的制备方案的设计,题目难度中等,明确制备原理及化学实验操作方法为解答关键,对学生来说高铁不是很熟悉,但是铁与亚铁之间的转化还是很容易实现的,起点高,落点低,是一道质量较好的题目.


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.01mol•L-1 H2SO4 | B. | pH=2的H2SO4溶液 | ||
| C. | c(OH-)=10-13mol•L-1 | D. | pH=1溶液加水稀释1倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 阴离子的还原性:Z>Y>X | B. | 单质的非金属性:X>Y>Z | ||
| C. | 气态氢化物的稳定性:X<Y<Z | D. | 原子原子半径:X>Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 据图可知,阳极反应式为2SO42--4e-=2SO3↑+O2↑ | |
| B. | 阳极失去2mol电子时,理论上可以得到11.2L氧气 | |
| C. | SO2在阴极与O2反应生成硫酸根,则方程式为SO2+O2+2e-=SO42- | |
| D. | CO2不参与电极反应,净化器中CO2浓度升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H++2e-=H2↑ | B. | Fe=Fe2++2e- | ||
| C. | 2H2O+O2+4e-=4OH- | D. | 4OH-=2H2O+O2↑+4e- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1.0 mol•L-1CH3COONa溶液中含有CH3COO-的个数为NA | |
| B. | 1.0 L 1.0 mol•L-1NaAlO2溶液中含有的铝原子数为NA | |
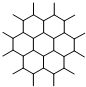
| C. | 如图是石墨晶体结构的俯视图,含1 mol C的石墨中六元环个数为$\frac{{N}_{A}}{2}$ | |
| D. | 22.4 L N2中所含的σ键数目为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com