
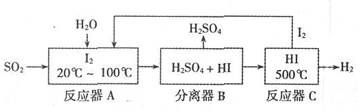
���� ����������FeS2��ȼ�ղ�����SO2�������ᣬ�ڷ�Ӧ��A�з�����Ӧ��SO2+I2+2H2O=2HI+H2SO4���ڷ�����B�У������H2SO4����Ӧ��C�еķ�ӦΪ��2HI?I2+H2������������ʽ��ӵ��ܷ�ӦΪ��SO2+2H2O=H2SO4+H2��
��1�����Ṥҵ�ϣ����ջ�������ȡSO2���ڷ���¯�У���CO��ԭ������������
��2���������ڱ������Ȼ�̼�����������Ȼ�̼��ˮ����Ӧ��Ҳ������ˮ���������ھƾ����Ҿƾ���ˮ��������Ȼ��ܣ�����ƽ���ƶ���ԭ������������H2�������������ƽ�������ƶ�������I2��H2�����ɣ�
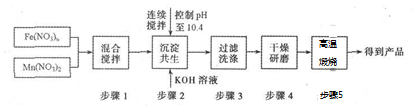
��3������MnFe2O4���Ʊ����̣���֪Mn��Fe�Ļ��ϼ�δ�䣬Mn��NO3��2��Mn�Ļ��ϼ�Ϊ+2����MnFe2O4��Fe�Ļ��ϼ�Ϊ+3���Ӷ����Fe��NO3��n�е�n��
��MnFe2O4�п�֪��Fe��Mn�ĸ���֮��Ϊ1��2�����������غ㣬���ԭ��Fe��NO3��n��Mn��NO3��2�����ʵ���֮�ȣ�
��4������2�С���������������Mn��OH��2��Fe��OH��3������������������MnFe2O4���ݴ���д����ʽ��
��5�����Ȼ�ѧѭ����ȡ�������ŵ��ǹ��̼�����Ⱦ�����Ͽ�ѭ��ʹ�á������������ڲ�ͬ�������ɣ���ȫ�����룻
��6�����������ܼ�̬���䣬�÷������������
��� �⣺��1�����Ṥҵ�ϣ����ջ�������ȡSO2���ڷ���¯�У���CO��ԭ����������������ʽΪ��Fe2O3+3CO$\frac{\underline{\;����\;}}{\;}$2Fe+3CO2��
�ʴ�Ϊ������¯��Fe2O3+3CO$\frac{\underline{\;����\;}}{\;}$2Fe+3CO2��
��2���������ڱ������Ȼ�̼�����������Ȼ�̼��ˮ����Ӧ��Ҳ������ˮ�����ٽ���Ͷ�������ķ�Ӧ���������ھƾ����Ҿƾ���ˮ��������Ȼ��ܣ�����Ϊ�˴ٽ����ܽ⣬��ʹ��Ӧ��ֽ��У����ڷ�Ӧ��A�м����������Ҵ�����Ĥ�������з�����Ӧ��2HI?I2+H2����H2�������������ƽ�������ƶ�������I2��H2�����ɣ����HI�ķֽ��ʣ�
�ʴ�Ϊ���Ҵ�����СH2Ũ�ȣ�ʹƽ�������ƶ������HI�ķֽ��ʣ�
��3��MnΪ+2�ۣ���MnFe2O4��Fe�Ļ��ϼ�Ϊ+3�ۣ���Fe��NO3��n��n=3��
��MnFe2O4�п�֪��Fe��Mn�ĸ���֮��Ϊ2��1������Fe��NO3��3��Mn��NO3��2 ���ߵ����ʵ���֮�� 2��1��
�ʴ�Ϊ��3�� 2��1��
��4��ԭ��Fe��NO3��n��Mn��NO3��2��MnΪ+2�ۣ�Fe�Ļ��ϼ�Ϊ+3�ۣ�Fe��NO3��3��Mn��NO3��2���������ط�Ӧ������Mn��OH��2��Fe��OH��3������������������MnFe2O4����ӦΪ��Mn��OH��2+2Fe��OH��3$\frac{\underline{\;����\;}}{\;}$MnFe2O4+4H2O��
�ʴ�Ϊ��Mn��OH��2+2Fe��OH��3$\frac{\underline{\;����\;}}{\;}$MnFe2O4+4H2O��
��5��A���ӷ�Ӧ�����ķ���ʽ��֪���÷�Ӧ���̼�����MnFe2O4��ѭ��ʹ�ã���A��ȷ��
B���ù��̵��ܷ�ӦΪ2H2O�TO2��+2H2����Ϊ�����������ķ�Ӧ��Ϊ���ȷ�Ӧ������������������B����
C����һ����730�����ϵ��¶ȣ��ܺ����ĸߣ���C����
D�������������ڲ�ͬ�������ɣ������ڸ��������������⣬��ȫ�����룬��D��ȷ��
�ʴ�Ϊ��AD��
��6��x=0.7ʱ�������ܼ�̬Ϊ��4-0.7����2-2=4.6����1mol MnFe2O4-0.7�к�Fe2+��Fe3+���ʵ����ֱ�Ϊxmol��ymol�����У�x+y=2��2x+3y=4.6����ã�x=1.4��y=0.6��
��1 mol MnFe2O4-0.7�к�Fe3+�����ʵ���Ϊ0.6 mol����Fe3+ռ�İٷ���Ϊ$\frac{0.6}{2}$��100%=30%��
�ʴ�Ϊ��30%��
���� �����ۺϿ������ʵ��Ʊ��������Լ�Ԫ�ػ�����֪ʶ���ۺ���������ã�Ϊ��Ƶ���㣬������ѧ���ķ��������ͼ��������Ŀ��飬ע��������ʵ������Լ�����ԭ������Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��50g��������Ϊ46%���Ҵ�ˮ��Һ�У�������ԭ����Ϊ3NA | |
| B�� | 80��ʱ��pH=13��Ba��OH��2��Һ�к��е�OH-��ĿΪ0.2NA | |
| C�� | lmol�л���CH3-CH=CH-CH2-CH3�������9NA��ԭ����ͬһƽ���� | |
| D�� | l04g����ϩ��C6H5-CH=CH2���к���8NA��̼�����4NA��̼̼˫�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CH4��g��+2NO2��g��?N2��g��+CO2��g��+2H2O��l����H��-867.0 KJ•mol-1 | |
| B�� | �����Ӽ����������ƽ�����ϵ��CO2�İٷֺ�����һ������ | |
| C�� | ʹ�ô��������Խ��ͷ�Ӧ�Ļ�ܣ����ٷ�Ӧ���ų������� | |
| D�� | ��״����4.48 L CH4�μӷ�Ӧ��ת�Ƶ�����Ϊ1.6 NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����Ƽ��ȡ�����Ĺ��չ����о�Ӧ���������ܽ�ȵIJ��� | |
| B�� | ������һ�գ���ˮ�����գ���ȡ֭������������ȡ�����صĹ����з����˻�ѧ�仯 | |
| C�� | �������ѩ��ǿ��֮���������𡱣��ϱ����պ뾰������صļ�����������������ɫ��Ӧ | |
| D�� | ʹ�ÿ�������Դ���ó��ٽ������̼����л��ܼ���ע��ԭ�ӵľ����ԡ����õ��ܺ��������յȶ�����ɫ��ѧ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | ʵ����� | ���� | ���ͻ���� |
| A | �ò�˿պȡ��ҺX������ɫ��Ӧʵ�� | ����ʻ�ɫ | ��ҺXһ����������Һ |
| B | ��Cl2ͨ��ʯ����Һ�� | ��Һ�ȱ�����ɫ | Cl2����Ư���� |
| C | ��NaHCO3��Һ�еμ�NaAlO2��Һ | �а�ɫ������������� | AlO2-��HCO3-������˫ˮ�ⷴӦ |
| D | ��FeBr2��Һ�м���������ˮ���ټ� CCl4�� | CCl4����ɫ | Fe2+�Ļ�ԭ��ǿ��Br- |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������ᾧ�������� | B�� | ������©�� | ||
| C�� | ��ȡ����Һ���Һ©�� | D�� | ����������װ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��H2S��ˮ��Һ�ڿ����з���ʱ��������ǣ���˵����H2S��ǿ�Ļ�ԭ�ԣ�
��H2S��ˮ��Һ�ڿ����з���ʱ��������ǣ���˵����H2S��ǿ�Ļ�ԭ�ԣ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
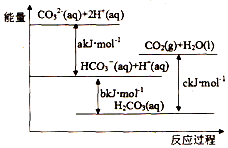
| A�� | H2CO3��aq��=CO2��g��+H2O��l��Ϊ���ȷ�Ӧ | |
| B�� | CO32-��aq��+H+��aq��=HCO3-��aq����H=akJ/mol | |
| C�� | HCO3-��aq��+H+��aq��=CO2��g��+H2O��l����H=��c-b��kJ/mol | |
| D�� | CO32-��aq��+2H+��aq��=CO2��g��+H2O��l����H=��a+b-c��kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ӷ�Ӧ | B�� | ���ȷ�Ӧ | C�� | ���ֽⷴӦ | D�� | ������ԭ��Ӧ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com