
(14分)合成氨是人类科学技术上的一项重大突破。
(1)NH3经一系列反应可以得到HNO3和NH4NO3。
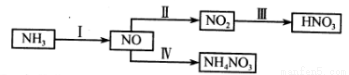
II中,2NO(g)+O2(g) 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下随温度变化的曲线如下图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下随温度变化的曲线如下图)。

①随温度升高,该反应平衡向__________(选填“正反应”或“逆反应”)方向移动。
②比较P1、P2的大小关系:______________。
(2)一种工业合成氨的简易流程图如下:
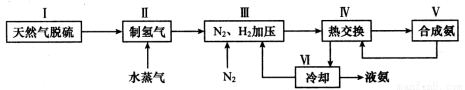
步骤II中制氢气原理如下:
a.CH4(g)+H2O(g) CO(g)+3H2(g) △H = +206.4 kJ/mol
CO(g)+3H2(g) △H = +206.4 kJ/mol
b.CO(g)+H2O(g) CO2(g)+H2(g) △H = —41.2 kJ/mol
CO2(g)+H2(g) △H = —41.2 kJ/mol
①对于反应a而言,增大CH4的浓度,达新平衡时H2的体积分数_ _ __增大(选填“一定”或“不一定”)。
②利用反应b,将CO进一步转化,可提高H2产量。若在500 ℃时,把等浓度的CO和H2O(g)充入反应容器,达到平衡时c(CO)=0.005 mol·L-1、c(H2)=0.015 mol·L-1,则CO的平衡转化率为 。
③上述流程图中,使合成氨放出的热量得到充分利用的主要步骤是(填序号) ,④简述一种本流程中可以提高合成氨原料总转化率的方法 。
19.(14分)(1)①逆反应 ②P2>P1 (2)①不一定 ②3/4或75% (3分)
③Ⅳ ④对原料气加压(或分离液氨后,未反应的N2、H2循环使用 )(3分)
【解析】
试题分析:(1)①由图像可知,随温度升高,NO的平衡转化率降低,说明该反应平衡向逆反应方向移动,2NO(g)+O2(g) 2NO2(g),增大压强,平衡正向移动,NO的平衡转化率升高,所以P2>P1;
2NO2(g),增大压强,平衡正向移动,NO的平衡转化率升高,所以P2>P1;
(2)①CH4(g)+H2O(g) CO(g)+3H2(g) △H = +206.4 kJ/mol增大 CH4的浓度,达新平衡时H2的体积分数不一定增大,②设CO的转化量为x CO + H2O
CO(g)+3H2(g) △H = +206.4 kJ/mol增大 CH4的浓度,达新平衡时H2的体积分数不一定增大,②设CO的转化量为x CO + H2O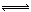 CO2 + H2
CO2 + H2
开始量(mol)0.02
转化量(mol) x x x x
平衡量(mol)0.005 0.015 0.015
可得CO转化率=0.015mol÷0.02mol×100%=75%
③上述流程图中,使合成氨放出的热量得到充分利用的主要步骤是Ⅳ;④提高合成氨原料总转化率方法是使合成氨平衡正向移动,所以对原料气加压或分离液氨后,未反应的N2、H2循环使用 。
考点:考查合成氨的工艺流程。


 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
| A、硅胶多孔,吸附水份能力强,所以常用作袋装食品的干燥剂 | B、“煤制油”是不可能实现的,“煤制油”属于伪科学 | C、烟气脱硫是防治酸雨的一种有效措施 | D、天然气属于高效清洁燃料 |
查看答案和解析>>
科目:高中化学 来源:2015届江苏省淮安市高三上学期第一次阶段性测试化学试卷(解析版) 题型:选择题
下列各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是
组别 | 甲 | 乙 | 丙 |
A | Al | HCl | NaOH |
B | NH3 | O2 | HNO3 |
C | SiO2 | NaOH | HF |
D | SO2 | Ca(OH)2 | NaHCO3 |
查看答案和解析>>
科目:高中化学 来源:2015届江苏省、常州一中、沭阳中学高三联合调研化学试卷(解析版) 题型:选择题
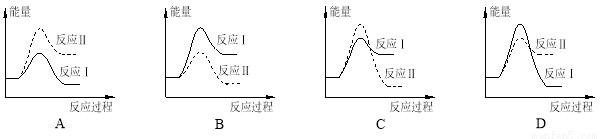
煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s) + CO(g) CaO(s) + SO2(g) + CO2(g) ΔH1=+218.4kJ·mol-1(反应Ⅰ)
CaO(s) + SO2(g) + CO2(g) ΔH1=+218.4kJ·mol-1(反应Ⅰ)
CaSO4(s) + 4CO(g) CaS(s) + 4CO2(g) ΔH2=-175.6kJ·mol-1(反应Ⅱ)
CaS(s) + 4CO2(g) ΔH2=-175.6kJ·mol-1(反应Ⅱ)
假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是
查看答案和解析>>
科目:高中化学 来源:2015届江苏省、常州一中、沭阳中学高三联合调研化学试卷(解析版) 题型:选择题
下表所列各组物质中,物质之间通过一步反应不能实现“甲 乙
乙 丙”转化的是
丙”转化的是
物质 选项 | 甲 | 乙 | 丙 |
A | Si | SiO2 | H2SiO3 |
B | NO | NO2 | HNO3 |
C | Na | NaCl | NaOH |
D | CH2=CH2 | CH3CH2OH | CH3CHO |
查看答案和解析>>
科目:高中化学 来源:2015届江苏省泰州市姜堰区高二上学期中考试化学试卷(选修)(解析版) 题型:选择题
在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g) zC(g),平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达到平衡时,测得A的浓度降低为0.30mol/L。下列有关判断正确的是
zC(g),平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达到平衡时,测得A的浓度降低为0.30mol/L。下列有关判断正确的是
A.B的转化率降低 B.平衡向正反应方向移动
C.x+y<z D.C的体积分数增大
查看答案和解析>>
科目:高中化学 来源:2015届江苏省泰州市姜堰区高二上学期中考试化学试卷(选修)(解析版) 题型:选择题
对于任何一个平衡体系,采用以下措施,一定会使平衡移动的是
A.升高温度 B.加入一种反应物
C.对平衡体系增加压强 D.使用催化剂
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三质量调研化学试卷(解析版) 题型:选择题
下列实验现象描述正确的是
A.碘水中加入少量裂化汽油振荡,静置后上层颜色变浅,下层颜色变为紫红色
B.红热的铜丝在氯气中燃烧,产生了棕黄色的雾
C.电解氯化钠饱和溶液,将阳极气体产物通入碘化钾淀粉溶液中,溶液变蓝
D.溴化钠溶液中加入少量新制的氯水振荡,再加入少量四氯化碳溶液振荡,静置后上层颜色变浅,下层颜色变为橙红色
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三上学期期中考试化学试卷(解析版) 题型:选择题
火法炼铜首先要焙烧黄铜矿,主要涉及以下反应:①2CuFeS2+O2= Cu2S+2FeS+SO2②Cu2S+O2=2Cu+SO2,下列说法正确的是
A.在反应①中:SO2既是氧化产物又是还原产物
B.在反应②中:Cu2S仅作还原剂,硫元素被氧化
C.在反应①中:每转移1.2 mol电子,有0.2 mol硫被氧化
D.在反应②中:每消耗1.0 molCu2S,有4.0 mol电子转移
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com