

分析 B与硫化氢反应得到淡黄色固体A,考虑A为硫,B与氯气反应得到C,C与硝酸钡反应得到白色沉淀F,且A与无色气体反应得到D,D与水反应得到B,可推知B为H2SO3,A为S,G为O2,D为SO2,C为H2SO4,E为BaSO3,F为BaSO4,以此解答该题.
解答 解:B与硫化氢反应得到淡黄色固体A,考虑A为硫,B与氯气反应得到C,C与硝酸钡反应得到白色沉淀F,且A与无色气体反应得到D,D与水反应得到B,可推知B为H2SO3,A为S,G为O2,D为SO2,C为H2SO4,E为BaSO3,F为BaSO4,
①B→C的离子方程式为:H2SO3+Cl2=4H++SO42-+2Cl-,故答案为:H2SO3+Cl2=4H++SO42-+2Cl-;
②D和G反应的化学方程式为:2SO2+O2$\frac{\underline{催化剂}}{△}$2 SO3,故答案为:2SO2+O2$\frac{\underline{催化剂}}{△}$2 SO3;
③过量的D通入Ba(OH)2溶液中的离子方程式为:OH-+SO2=HSO3-,故答案为:OH-+SO2=HSO3-.
点评 本题考查无机物推断,为高考常见题型,侧重考查学生的分析能力,题目涉及硫元素单质化合物的性质与转化,物质的颜色是推断突破口,难度中等.


 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ①③⑥ | C. | ③⑤⑥ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇可以与水蒸气反应生成氢气,反应方程式如下:
甲醇可以与水蒸气反应生成氢气,反应方程式如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用稀AgNO3溶液洗涤AgCl沉淀比用水洗涤损耗AgCl小 | |
| B. | 对于Al(OH)3(s)?Al(OH)3(aq)?Al3++3OH-,前者为溶解平衡,后者为电离平衡 | |
| C. | 已知AgCl的 KSP=1.8×10-10,将AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-) | |
| D. | 将KI溶液加入到AgCl的饱和溶液中,产生黄色沉淀,说明AgCl溶解度大于AgI |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3molI2转移的电子数为6NA | |
| B. | 7.8gNa2O2固体中含有的阴离子数为0.2NA | |
| C. | 标准状况下,体积为2.24 L的CO2和SO2的混合气体中含有的氧原子数为0.2 NA | |
| D. | 0.l mol Cl2参加氧化还原反应,转移的电子数目一定是0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
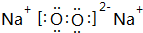 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{ab}{23}$mol | B. | $\frac{a(b+1)}{23}$mol | C. | $\frac{18ab}{23}$g | D. | $\frac{18a(b+1)}{23}$mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对二甲苯与酸性高锰酸钾溶液发生反应;甲烷与酸性高锰酸钾溶液不反应 | |
| B. | 甲苯与浓硝酸和浓硫酸混合液,加热;苯与浓硝酸和浓硫酸混合液,加热 | |
| C. | 乙苯与氢气在催化剂作用下加热反应;苯与氢气在催化剂作用下加热反应 | |
| D. | 邻二甲苯与氯气在光照下发生反应;甲烷在光照下与氯气发生反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com