
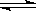 SO3(g);△H=-98 kJ·mol-1。开始时在100 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出热量196 kJ,该温度下平衡常数K= 。恒温下,若往容器中再加入4mol SO2(g),则重新达到平衡时SO2的总转化率 原平衡时SO2转化率(选填“>”、“<”或“=”)。
SO3(g);△H=-98 kJ·mol-1。开始时在100 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出热量196 kJ,该温度下平衡常数K= 。恒温下,若往容器中再加入4mol SO2(g),则重新达到平衡时SO2的总转化率 原平衡时SO2转化率(选填“>”、“<”或“=”)。 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源:不详 题型:填空题
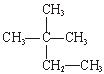 ③白磷 ④氯气 ⑤
③白磷 ④氯气 ⑤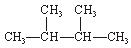
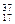 Cl ⑦
Cl ⑦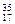 Cl ⑧红磷
Cl ⑧红磷查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| | | A-B | A=B | A≡B |
| CO | 键能(kJ/mol) | 357.7 | 798.9 | 1071.9 |
| 键能差值kJ/mol) | 441.2 273 | |||
| N2 | 键能(kJ/mol) | 154.8 | 418.4 | 941.7 |
| 键能差值kJ/mol) | 263.6 523.3 | |||
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.羟基(-OH)和氢氧根(OH-) | B.甲烷(CH4)和铵根(NH4+) |
| C.氨气(NH3)和水(H2O) | D.双氧水(H2O2)氯化氢(HCl) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com