
| A、①②④⑤ | B、①②③④⑤ |
| C、①④ | D、①④⑤ |
科目:高中化学 来源: 题型:
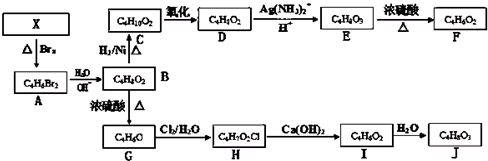
查看答案和解析>>
科目:高中化学 来源: 题型:
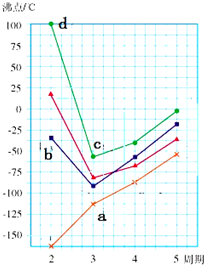 A、B、D、E、F、G是原子序数依次增大的六种短周期元素.A和B能形成B2A和B2A2两种化合物,B、D、G的最高价氧化物对应水化物两两之间都能反应,D、F、G原子最外层电子数之和等于15.
A、B、D、E、F、G是原子序数依次增大的六种短周期元素.A和B能形成B2A和B2A2两种化合物,B、D、G的最高价氧化物对应水化物两两之间都能反应,D、F、G原子最外层电子数之和等于15.查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
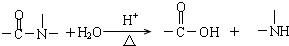 ,下列说法正确的是( )
,下列说法正确的是( )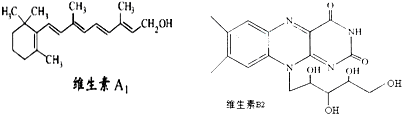
| A、1mol维生素A1最多与溴水中的4molBr2发生加成反应 |
| B、维生素A1的分子式为C19H30O,是一种易溶于水的高分子 |
| C、维生素B2在酸性条件下彻底水解后得到的有机物,其分子内发生酯化得多种酯 |
| D、用-C4H9取代维生素B2苯环上的一个H原子,最多可得4种同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
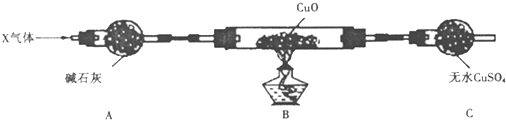
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,PbSO4易溶于pH=7的CH3COONH4溶液,说明(CH3COO)2Pb是弱电解质 |
| B、向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,则Ksp(BaCO3)<Ksp(BaSO4) |
| C、潜艇上的核反应堆使用液态铝-钠合金作载热介质,若合金中n(Na)>n(Al),将其投入到足量的水中可得无色透明溶液 |
| D、向两支盛有KI3溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀,说明KI3溶液中存在平衡:I3-═I2+I- |
查看答案和解析>>
科目:高中化学 来源: 题型:
c(N
| ||
| c(NH.3H2O) |
| c(NH.3H2O) |
| c(OH-) |
| c(OH-) |
| c(H+) |
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
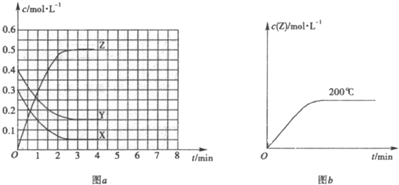
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、适当摄入油脂,有助于人体吸收多种脂溶性维生素 |
| B、人体缺乏维生素D易引起夜盲症 |
| C、相对于各成分金属来说,合金的熔点更高,硬度更大 |
| D、柠檬酸在体内可以彻底氧化生成二氧化碳和水,所以柠檬是酸性食物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com