
| A. | 通入过量Cl2:Cl-、Fe2+、SO42-、Al3+ | |
| B. | 加入过量NaOH溶液:Na+、AlO2-、SO42-、OH- | |
| C. | 加入过量氨水:Na+、NH4+、SO42-、AlO2- | |
| D. | 加入过量铜粉:NO3-、Fe3+、SO42-、Al3+ |
分析 铝热反应后的混合物含Fe、氧化铝,Fe与硫酸反应生成硫酸亚铁,氧化铝与硫酸反应生成硫酸铝,结合离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应等,则离子大量共存,以此来解答.
解答 解:A.Fe2+与Cl2发生氧化还原反应,不能大量存在,故A不选;
B.加入过量NaOH溶液,亚铁离子转化为沉淀,铝离子与NaOH反应生成偏铝酸钠,则溶液中存在Na+、AlO2-、SO42-、OH-,故B选;
C.加入过量氨水,铝离子转化为沉淀,不能存在AlO2-,故C不选;
D.Cu与Fe3+发生氧化还原反应,不能大量存在Fe3+,故D不选;
故选B.
点评 本题考查离子共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应的判断,题目难度不大.


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2溶于水产生O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| B. | 钠与CuSO4溶液反应:2Na+Cu2+═Cu↓+2Na+ | |
| C. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| D. | Ba(OH)2溶液与稀H2SO4反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
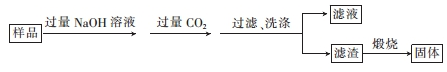
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若HA、HB均为弱酸,酸性:HA>HB,则相同条件下,溶液的pH大小为NaA>NaB | |
| B. | 相同条件下,将pH=11的NaOH溶液和和氨水分别稀释pH=9的溶液,所加水的体积前者大 | |
| C. | pH=3的醋酸与pH=1的NaOH溶液等体积混合时,溶液中离子浓度的大小顺序是:c(Na+)>c(CHCOO-)>c(OH-)>c(H+) | |
| D. | 0.1mol/L的某二元弱酸盐Na2A溶液中,c(Na+)=2[c(HA-)+c(A2-)+c(H2A)] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一电离能:Y<X | |
| B. | 最简单气态氢化物的稳定性:HmY>HnX | |
| C. | 最高价含氧酸的酸性:元素X对应酸的酸性强于Y | |
| D. | X和Y形成的化合物中,X显负价,Y显正价 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在NaOH溶液中滴入几滴NH4Cl溶液:NH4++OH-═NH3↑+H2O | |
| B. | 氟气通入水中:2F2+2H2O═4H++4F-+O2 | |
| C. | AlCl3溶液中通入过量的氨气:Al3++3NH3•H2O═Al(OH)3↓+3NH${\;}_{4}^{+}$ | |
| D. | 将少量铜屑放入浓硝酸中:Cu+4 H++2NO3-═Cu2++2 NO2↑+2 H2O |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上10月月考化学试卷(解析版) 题型:选择题
化学与社会、环境等密切相关。下列说法错误的是( )
A.“低碳经济”是指减少对化石燃料的依赖,达到低污染、低排放的模式
B.“低碳生活”倡导生活中耗用能量尽量减少,从而减少CO2的排放
C.所有垃圾都可以采用露天焚烧或深埋的方法处理
D.“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”都能提高空气质量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com