
| A. | pH=3的醋酸与pH=11的氢氧化钾 | B. | 0.1mol/L的盐酸与0.1mol/L的氨水 | ||
| C. | 0.001mol/L的盐酸与pH=11的氨水 | D. | pH=3的盐酸与0.001mol/L的氨水 |
分析 A.醋酸为弱酸,混合液中醋酸过量,溶液呈酸性,溶液的pH小于7;
B.二者恰好反应生成氯化铵,铵根离子部分水解,溶液呈酸性,溶液的pH小于7;
C.氨水为弱碱,混合液中氨水过量,溶液呈碱性,溶液的pH大于7;
D.pH=3的盐酸中氢离子浓度为0.001mol/L,二者恰好反应生成氯化铵,溶液呈酸性.
解答 解:常温下溶液的pH一定大于7,则反应后溶液呈碱性,
A.pH=3的醋酸与pH=11的氢氧化钾溶液等体积反应,由于醋酸为弱酸,pH=3的溶液中氢离子浓度为0.001mol/L,醋酸的浓度大于0.001mol/L,则混合液中醋酸过量,反应后溶液呈酸性,故A错误;
B.0.1 mol/L的盐酸与0.1 mol/L的氨水等体积混合,二者恰好反应生成强酸弱碱盐氯化铵,溶液呈酸性,故B错误;
C.氨水为弱碱,0.001 mol/L的盐酸与pH=11的氨水等体积混合,氨水过量,溶液一定呈碱性,故C正确;
D.pH=3的盐酸的浓度为0.001mol/L,与0.001 mol/L的氨水等体积反应后,恰好生成氯化铵,溶液呈酸性,故D错误;
故选C.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握弱电解质的电离特点,试题培养了学生的分析能力及灵活应用基础知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 钠原子的结构示意图: | |
| B. | 过氧化钠的电子式: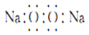 | |
| C. | 小苏打在水中的电离方程式:NaHCO3═Na++HCO3- | |
| D. | 硫化钠的水溶液呈碱性的原因:S2-+2H2O?H2S+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
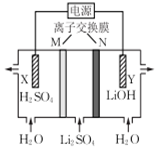
| A. | X电极连接电源负极 | |
| B. | N为阳离子交换膜 | |
| C. | Y电极反应式为O2+2H2O+4e-═4OH- | |
| D. | 制备2.4 g LiOH产生的H2在标准状况下为2.24 L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 草酸(H2C2O4)是一种二元弱酸,部分性质如下:能溶于水,易溶于乙醇;大约在175℃升华(175℃以上分解生成H2O、CO2和CO);H2C2O4+Ca(OH)2=CaC2O4↓+2H2O.现用H2C2O4进行如下实验:
草酸(H2C2O4)是一种二元弱酸,部分性质如下:能溶于水,易溶于乙醇;大约在175℃升华(175℃以上分解生成H2O、CO2和CO);H2C2O4+Ca(OH)2=CaC2O4↓+2H2O.现用H2C2O4进行如下实验:
| 实验组别 | c(H2C2O4) /(mol/L) | V(H2C2O4) /ml | c(KMnO4) /(mol/L) | V(KMnO4) /ml | c(H2SO4) /(mol/L) | 褪色所需时间 | 实验 目的 |
| 1 | 0.2 | 2 | 0.0025 | 4 | 0.12 | 6′55″ | (a)探究KMnO4溶液浓度对化学反应速率的影响 |
| 0.2 | 2 | 0.005 | 4 | 0.12 | 5′17″ | ||
| 0.2 | 2 | 0.01 | 4 | 0.12 | 3′20″ | ||
| 0.2 | 2 | 0.02 | 4 | 0.12 | 9′05″ | ||
| 0.2 | 2 | 0.03 | 4 | 0.12 | 11′33″ | ||
| 0.2 | 2 | 0.04 | 4 | 0.12 | 14′20″ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应的焓变与反应的途径无关 | |
| B. | 盐酸与氢氧化钠溶液的反应中一定有化学键的断裂和形成 | |
| C. | 白酒的蒸馏、石油的分馏、煤的干馏都是化学变化 | |
| D. | 研发新型催化剂,提高石油和煤中各组分的燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.4mol | B. | 0.3mol | C. | 0.2mol | D. | 0.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(OH)3胶体与硫酸溶液混合会聚沉成红褐色沉淀 | |
| B. | Fe(OH)3胶体粒子在电场影响下会发生电泳现象 | |
| C. | Fe(OH)3胶体粒子在不停地做布朗运动 | |
| D. | 光线通过Fe(OH)3胶体时会发生丁达尔现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入催化剂,改变了反应的途径,反应的△H也随之改变 | |
| B. | 增加反应物的浓度平衡向正向移动,平衡常数增加 | |
| C. | 升高温度,反应速率加快,反应放出的热量不变 | |
| D. | 改变压强,平衡不发生移动,反应放出的热量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 事 实 | 解 释 |
| A | 锌与盐酸反应,加入氯化钠溶液,速率加快 | 增大了氯离子的浓度,使反应速率增加 |
| B | 锌与稀硫酸反应,加入较多硫酸铜溶液,生成氢气的速率加快 | 形成铜锌原电池,使生成氢气的速率加快 |
| C | 在5%的双氧水中加入二氧化锰粉末,分解速率迅速加快 | 降低了反应的焓变,活化分子数增多,有效碰撞增多,反应速率加快 |
| D | 面粉成产车间容易发生爆炸 | 固体表面积大,反应速率加快 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com