
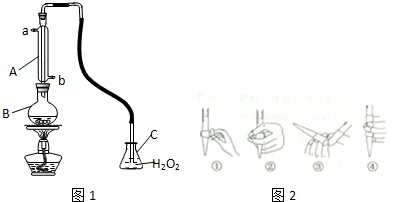
| 1 |
| 2 |
| 0.72g |
| 0.3L |


科目:高中化学 来源: 题型:
| A、将氧化铝溶于水 |
| B、将氧化铝先溶于盐酸中,之后滴加氨水 |
| C、将氧化铝溶于盐酸中,之后滴加氢氧化钠溶液 |
| D、将氧化铝溶于氢氧化钾 |
查看答案和解析>>
科目:高中化学 来源: 题型:
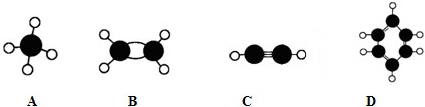
 下列有关绿原酸(结构简式如图)的说法不正确的是( )
下列有关绿原酸(结构简式如图)的说法不正确的是( )| A、分子式为C16H18O9 |
| B、1mol绿原酸最多能与8mol NaOH反应 |
| C、1mol绿原酸最多能与4mol H2反应 |
| D、能发生取代反应、消去反应、加成反应和氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO) (×10-4mol?L-1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO) (×10-3mol?L-1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
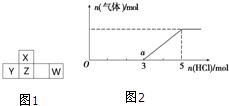 短周期元素X、Y、Z、W在周期表中的位置如图1所示,其中W的氧化物是酸雨形成的主要物质.
短周期元素X、Y、Z、W在周期表中的位置如图1所示,其中W的氧化物是酸雨形成的主要物质.| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
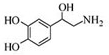 去甲肾上腺素可以调控动物机体的植物性神经功能,其结构简式如图所示,下列说法正确的是( )
去甲肾上腺素可以调控动物机体的植物性神经功能,其结构简式如图所示,下列说法正确的是( )| A、每个去甲肾上腺素分子中含有3个酚羟基 |
| B、每个去甲肾上腺素分子中含有1个手性碳原子 |
| C、1mol去甲肾上腺素最多与2mol Br2发生取代反应 |
| D、去甲肾上腺素既能与盐酸反应,又能与氢氧化钠溶液反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com