
| A. | 在0.1mol/LNaHCO3 溶液中有:c(Na+)>c(HCO3-)+c(CO32-)+c(OH-) | |
| B. | 在NaHSO4溶液中有:c(Na+)=c(SO42-)=c(H+) | |
| C. | 在新制氯水中加入KOH至溶液呈中性,则溶液中有:c(K+)=2c(ClO-)+C(HClO) | |
| D. | 将等物质的量浓度的Na2SO3溶液和NaHSO4溶液等体积混合后的混合溶液中:c(OH-)-c(H2SO3)=c(H+)+c(SO32-) |
分析 A.依据溶液中电荷守恒分析,溶液中H+浓度大于CO32-离子浓度;
B.在NaHSO4溶液中硫酸氢钠完全电离生成钠离子、氢离子和硫酸根离子,同时存在水的电离平衡,水电离出氢离子、氢氧根离子;
C.根据物料守恒和电荷守恒判断;
D.将等物质的量浓度的Na2SO3溶液和NaHSO4溶液等体积混合后的混合溶液中溶质为NaHSO3和Na2SO4,依据溶液中质子守恒分析判断.
解答 解:A.在0.1mol/LNaHCO3 溶液中电荷守恒c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)溶液中H+浓度大于CO32-离子浓度,c(Na+)<c(HCO3-)+c(CO32-)+c(OH-),故A错误;
B.在NaHSO4溶液中硫酸氢钠完全电离生成钠离子、氢离子和硫酸根离子,同时存在水的电离平衡,水电离出氢离子、氢氧根离子,c(Na+)=c(SO42-)<c(H+),故B错误;
C.混合溶液呈中性,则c(H+)=c(OH-),溶液中存在电荷守恒,c(K+)+c(H+)=c(OH-)+c(ClO-)+c(Cl-),所以得c(K+)=c(ClO-)+c(Cl-),根据物料守恒得c(Cl- )=c(ClO-)+c(HClO),所以得c(K+)=2c(ClO-)+c(HClO),故C正确;
D.将等物质的量浓度的Na2SO3溶液和NaHSO4溶液等体积混合后的混合溶液中溶质为NaHSO3和Na2SO4,NaHSO3溶液中存在质子守恒,c(OH-)+c(SO32-)=c(H2SO3)+c(H+),c(OH-)-c(H2SO3)=c(H+)-c(SO32-),故D错误;
故选C.
点评 本题考查了电解质溶液中电荷守恒、物料守恒、质子守恒等定量关系的分析应用,主要是离子浓度大小的判断,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:实验题
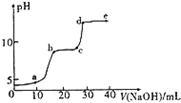 某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程.
某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程.| 较大量存在的含金属元素的离子 | 检验方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
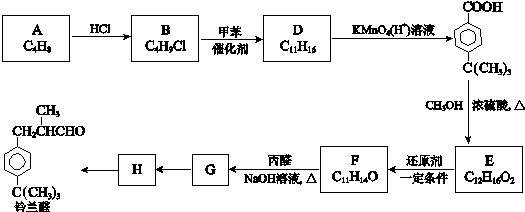
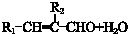
 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$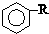 +HCl
+HCl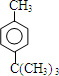 .
.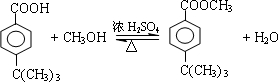 .
. .
. .
. .
.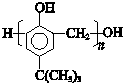 ,合成路线是(不需写化学方程式)
,合成路线是(不需写化学方程式)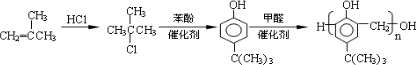 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蔬菜表面洒少许福尔马林,可保鲜和消毒 | |
| B. | 推广使用可降解塑料及布质购物袋,以减少“白色污染” | |
| C. | 绿色食品就是不使用化肥农药,不含任何化学物质的食品 | |
| D. | 推广使用煤液化技术可减少二氧化碳温室气体的排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若两种离子分别为X2-,Y-,则X2-的还原性一定大于Y- | |
| B. | 若两种离子分别为Xa+,Yb-,则由mXa+与nYb-得,m+a=n-b | |
| C. | X、Y一定不是同周期元素 | |
| D. | 若X的原子半径大于Y,则气态氢化物的稳定性HmX一定大于HnY |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氢氟酸来刻蚀玻璃:SiO2+4H++4F-═SiF4↑+2H2O | |
| B. | 用石墨电极电解AlCl3溶液:2Al3++6H2O═2Al(OH)3↓+3H2↑ | |
| C. | 铅蓄电池放电时的反应:Pb+PbSO4+4H++SO42-═2Pb2++SO42-+2H2O | |
| D. | 酸性高锰酸钾溶液与草酸反应:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有NH4+、Cl-、H+、OH-的溶液中,离子浓度一定是c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | pH=6的醋酸与醋酸钠的混合溶液中:c(Na+)>c(CH3COO-) | |
| C. | 将0.2 mol•L-1 CH3COOH溶液和0.1 mol•L-1 NaOH溶液等体积混合,则反应后的混合溶液中:2c(OH-)+c(CH3COO-)═2c(H+)+c(CH3COOH) | |
| D. | pH=8的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2015年8月12号接近午夜时分,天津滨海新区一处集装箱码头发生爆炸.发生爆炸的是集装箱内的易燃易爆物品,爆炸火光震天,并产生巨大蘑菇云.根据掌握的信息分析,装箱区的危险化学品可能有钾、钠、氯酸钠、硝酸钾、烧碱,硫化碱、硅化钙、三氯乙烯、氯碘酸等.运抵区的危险化学品可能有环己胺、二甲基二硫、甲酸、硝酸铵、氰化钠、4,6-二硝基苯-邻仲丁基苯酚等.
2015年8月12号接近午夜时分,天津滨海新区一处集装箱码头发生爆炸.发生爆炸的是集装箱内的易燃易爆物品,爆炸火光震天,并产生巨大蘑菇云.根据掌握的信息分析,装箱区的危险化学品可能有钾、钠、氯酸钠、硝酸钾、烧碱,硫化碱、硅化钙、三氯乙烯、氯碘酸等.运抵区的危险化学品可能有环己胺、二甲基二硫、甲酸、硝酸铵、氰化钠、4,6-二硝基苯-邻仲丁基苯酚等.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com