
【题目】铁的化合物有广泛用途,如碳酸亚铁(FeCO3)可作为补血剂,铁红(Fe2O3)可作为颜料。利用某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)制备碳酸亚铁的流程如下:

(1)“酸溶”时加快反应速率的方法有___________________(写出一种)。
(2)①“还原”时,FeS2与H2SO4不反应,Fe3+通过两个反应被还原,其中一个反应如下:FeS2 +14Fe3+ +8H2O=15Fe2++2SO42-+16H+,则另一个反应的离子方程式为:___________;
②FeS2还原后,检验Fe3+是否反应完全的方法是___________。
(3)①“沉淀”时,需控制pH不宜过高,否则生成的FeCO3中可能混有___杂质;
②写出加入NH4HCO3生成“沉淀”的化学方程式:___________________;
③所得FeCO3需充分洗涤,检验沉淀已洗涤干净的方法是_________________。
(4)FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,同时释放出CO2,则与FeCO3反应的物质为_________(填化学式)。
(5)FeCO3在空气中煅烧生成Fe2O3时,也会生成FeO。现煅烧34.8g的FeCO3,得到Fe2O3和FeO的混合物23.76g。则Fe2O3的质量为______ g。
【答案】适度加热、适量增加硫酸的浓度、将烧渣粉碎、搅拌等FeS2+2Fe3++=3Fe2++2S取少量溶液,滴入几滴KSCN溶液,若溶液变为血红色,说明其中含有Fe3+,反之,未反应完全Fe(OH)2FeSO4+2NH4HCO3=(NH4)2SO4+FeCO3↓+H2O+CO2↑取少许最后一次洗涤液于试管中,滴加稍过量稀盐酸,无明显现象,再滴加BaCl2溶液,若无白色沉淀生成,则表明已洗涤干净O2、H2O21.6
【解析】
烧渣(主要成分Fe2O3、FeO,还有一定量的SiO2)用硫酸浸取,过滤后含有硫酸铁、硫酸亚铁、未反应的硫酸,滤渣为二氧化硅,用二硫化亚铁还原Fe3+后过滤,得滤液中含有硫酸亚铁,向滤液中加入碳酸铵,过滤得碳酸亚铁,滤液中含有硫酸铵、碳酸铵。
可以通过加热、增加硫酸的浓度、将烧渣粉碎、搅拌等措施提高酸浸时反应速率;(2)①Fe3+被FeS2还原成Fe2+,发生反应的离子方程式包括:FeS2+14Fe3++8H2O=15Fe2++2SO42—+16H+、FeS2+2Fe3++=3Fe2++2S;②Fe3+与KSCN溶液反应呈血红色,检验Fe3+是否反应完全可选择KSCN溶液,具体方法是取少量溶液,滴入几滴KSCN溶液,若溶液变为血红色,说明其中含有Fe3+,反之,未反应完全;(3)①pH过高时溶液生成氢氧化亚铁沉淀;②加入NH4HCO3生成“沉淀”的化学方程式为FeSO4+2NH4HCO3=(NH4)2SO4+FeCO3↓+H2O+CO2↑;③碳酸亚铁表面会附着硫酸铵,所以检验FeCO3是否洗净,可以检验洗涤滤液中是否有硫酸根离子,具体方法为:取少许最后一次洗涤液于试管中,滴加稀盐酸,无明显现象,再滴加BaCl2溶液,若无白色沉淀生成,则表明已洗涤干净;(4)红褐色固体是Fe(OH)3,FeCO3、H2O和O2反应生成Fe(OH)3和CO2;(5)在空气中煅烧FeCO3生成氧化铁和氧化亚铁,设Fe2O3的物质的量为x mol,FeO的物质的量为y mol,根据化学反应前后铁元素守恒可得:①2x+y=0.3,②160x+72y=23.76,联立解得x=0.135,可知Fe2O3的质量为21.6g。


科目:高中化学 来源: 题型:
【题目】肼是一种强还原剂,用NaClO与NH3反应可用于生产肼(N2H4),其反应的化学方程式为:NaClO+2NH3= N2H4+NaCl+H2O。
⑴生产1000 g质量分数为25.6%的肼溶液最少需要___________L(标准状况)NH3。
⑵工业次氯酸钠溶液中含有氯酸钠会影响所得肼的产品质量。测定次氯酸钠样品中的氯酸钠含量的方法如下:取10.00 mL 碱性NaClO溶液试样,加入过量H2O2,将次氯酸钠完全还原(ClO3-在酸性条件下具有强氧化性,但碱性条件下几乎无氧化性),加热煮沸,冷却至室温,加入硫酸至酸性,再加入0.1000 mol·L-1 硫酸亚铁标准溶液30.00 mL,充分反应后,用0.01000 mol·L-1酸性K2Cr2O7溶液滴定至终点(Cr2O72-被还原为Cr3+),消耗该溶液20.00 mL。
①用H2O2与次氯酸钠反应的离子方程式为___________。
②实验中加热煮沸的目的是___________。
③计算样品中NaClO3的含量(以g·L-1表示),写出计算过程。___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
①钢铁表面烤蓝生成一层致密的Fe3O4,能起到防腐蚀作用;②砹(At)是第ⅦA族,其氢化物的稳定性大于HCl;③Na2FeO4可做水的消毒剂和净化剂;④陶瓷、玻璃、水晶、玛瑙、水泥、光导纤维的主要成分都是硅酸盐;⑤铊(Tl)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应;⑥第三周期金属元素的最高价氧化物对应的水化物,其碱性随原子序数的增大而减弱;⑦海水提镁的主要步骤为:
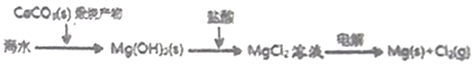
A. ①③④⑦ B. ①③⑥ C. ③④⑤⑦ D. ②④⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是一个巨大的化学资源宝库,利用海水可以获得很多化工产品。
(1)海水中制得的氯化钠可用于生产烧碱及氯气。反应的离子方程式是______________。
(2)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去):
![]()
将Br2与Na2CO3反应的化学方程式补充完整:_________
![]()
(3)盐卤蒸发冷却后析出卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+、Mn2+等离子。以卤块为原料制得镁的工艺流程如下(部分操作和条件已略去):
生成氢氧化物沉淀的pH
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH) 2 | 9.6 | 11.1 |
①步骤②中需控制pH=9.8,其目的是________________________________。
②用NaClO 氧化Fe2+得到Fe(OH)3沉淀的离子反应方程式是______________________。
③步骤③需在HCl保护气中加热进行,请用化学平衡移动原理解释原因________。
④NaClO还能除去盐卤中的CO(NH2)2,生成盐和能参与大气循环的物质。除去0.1mol CO(NH2)2时消耗NaClO_______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子能大量共存的是( )
A.Ca2+、HCO3-、K+、NO3-B.HCO3-、H+、Ba2+、Na+
C.HCO3-、OH-、Al3+、Na+D.Mg2+、Fe3+、OH-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低、燃料易于贮运及污染小等特点。如图为镁——次氯酸盐燃料电池的工作原理图,下列有关说法不正确的是( )
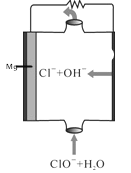
A. 该燃料电池中镁为负极,发生氧化反应
B. 正极反应式为ClO―+H2O+2e―= Cl―+2OH―
C. 放电过程中OH―移向正极移动.
D. 电池总反应式为Mg+ClO―+H2O=Mg(OH)2↓+Cl―
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com