
| 实验序号 | a | b | c |
| 合金质量/mg | 510 | 765 | 918 |
| 气体体积/mL | 560 | 672 | 672 |
| ||
| ||
| ||
| 16×3 |
| 16×3+27×2 |
| ||
| 16 |
| 16+24 |
| 24g |
| xg |
| 22.4L |
| VL |
| 54g |
| yg |
| 67.2L |
| VL |
| 0.03mol×2 |
| 0.03L |
| 3 |
| 2 |
| 0.560L |
| 22.4L/mol |
| 0.01mol×24g?mol-1 |
| 0.510g |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

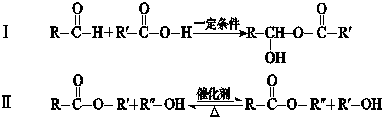
 RO-CH2-OR
RO-CH2-OR| a.D→E的反应类型为消去反应 | b.D能与Na、NaOH、NaHCO3反应 |
| c.Q是一种水溶性很好的高分子化合物 | d.G在酸性或碱性环境中均能水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com