
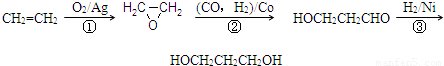
| C2H4 | O2 | N2 | ||
| ��Ӧǰ������� | 25.0% | 15.0% | 60.0% | |
| ijһʱ��������� | 5.56% | 5.54% | 66.7% | 22.2% |
 CO+H2
CO+H2  CO+3H2
CO+3H2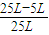 ×100%=80.0%
×100%=80.0%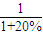 =
=
 m��H2��×
m��H2��× m��HOCH2CH2CHO��
m��HOCH2CH2CHO��
 CO+H2 CH4+H2O
CO+H2 CH4+H2O CO+3H2
CO+3H2 x
x  x y
x y  y
y  y
y x+
x+ y=16.8��
y=16.8�� x+
x+ y=2.4
y=2.4


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| �� �� | ȼ���ȣ�kJ?mol-1�� |
| H2��g�� | -285.8 |
| CO��g�� | -283.0 |
| CH4��g�� | -890.3 |
| ��Ӧ�¶�/�� | ƽ�ⳣ�� | ��Ӧ�¶�/�� | ƽ�ⳣ�� |
| 0 | 667.30 | 200 | 1.909��10-2 |
| 100 | 12.92 | 300 | 2.42��10-4 |
 HOCH2CH2CHO
HOCH2CH2CHO  HOCH2CH2CH2OH
HOCH2CH2CH2OH
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
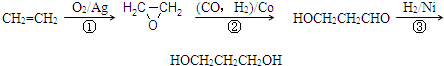
| C2H4 | O2 | N2 | ||
| ��Ӧǰ������� | 25.0% | 15.0% | 60.0% | 0 |
| ijһʱ��������� | 5.56% | 5.54% | 66.7% | 22.2% |
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �� �� | ȼ���ȣ�kJ?mol-1�� |
| H2��g�� | -285.8 |
| CO��g�� | -283.0 |
| CH4��g�� | -890.3 |
| 2a |
| V |
| 2a |
| V |

| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010�꽭��ʡ��ͨ��ͨ�����߿���ѧģ���Ծ��������棩 ���ͣ������
| �� �� | ȼ���� |
| H2��g�� | -285.8 |
| CO��g�� | -283.0 |
| CH4��g�� | -890.3 |
| ��Ӧ�¶�/�� | ƽ�ⳣ�� | ��Ӧ�¶�/�� | ƽ�ⳣ�� |
| 667.30 | 200 | 1.909×10-2 | |
| 100 | 12.92 | 300 | 2.42×10-4 |
 HOCH2CH2CHO
HOCH2CH2CHO  HOCH2CH2CH2OH
HOCH2CH2CH2OH CO+H2 CH4+H2O
CO+H2 CH4+H2O  CO+3H2
CO+3H2�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com