
 的合成路线如下:
的合成路线如下: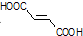
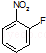 中含有的官能团名称为硝基,氟原子.
中含有的官能团名称为硝基,氟原子.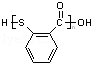 .
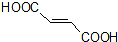
. 分析 A的系统命名为1,4-二溴-2-丁烯,则A的结构简式为BrCH2CH=CHCH2Br,则可知C4H6与溴发生1,4-加成反应得A,A为BrCH2CH=CHCH2Br,A碱性水解得B为HOCH2CH=CHCH2OH,B与溴化氢加成得C为HOCH2CH2CHBrCH2OH,C被氧化成D为HOOCCH2CHBrCOOH,D在氢氧化钠醇溶液中发生消去反应再酸化得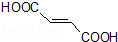 ,
,
(1)根据结构简式确定含有的官能团;
(2)根据上面的分析可知,反应①的类型是 加成反应,反应③的目的是 保护碳碳双键,防止被酸性KMnO4氧化;
(3)反应②的化学方程式为BrCH2CH=CHCH2Br+2NaOH$\stackrel{△}{→}$HOCH2CH=CHCH2OH+2NaBr;
(4)B为HOCH2CH=CHCH2OH,物质B的同分异构体中既含有羟基,又含有醛基的同分异构体为HOCH2CH2CH2CHO、CH3CHOHCH2CHO、CH3CH2CHOHCHO、HOCH2CH(CH3)CHO、(CH3)2COHCHO;
(5) 可发生缩聚反应.
可发生缩聚反应.
解答 解:A的系统命名为1,4-二溴-2-丁烯,则A的结构简式为BrCH2CH=CHCH2Br,则可知C4H6与溴发生1,4-加成反应得A,A为BrCH2CH=CHCH2Br,A碱性水解得B为HOCH2CH=CHCH2OH,B与溴化氢加成得C为HOCH2CH2CHBrCH2OH,C被氧化成D为HOOCCH2CHBrCOOH,D在氢氧化钠醇溶液中发生消去反应再酸化得 ,
,
(1)有机物  中含有的官能团名称为硝基、氟原子,故答案为:硝基;氟原子;
中含有的官能团名称为硝基、氟原子,故答案为:硝基;氟原子;
(2)根据上面的分析可知,反应①的类型是 加成反应,反应③的目的是 保护碳碳双键,防止被酸性KMnO4氧化,
故答案为:加成;保护碳碳双键,防止被酸性KMnO4氧化;
(3)反应②的化学方程式为BrCH2CH=CHCH2Br+2NaOH$\stackrel{△}{→}$HOCH2CH=CHCH2OH+2NaBr,故答案为:BrCH2CH=CHCH2Br+2NaOH$\stackrel{△}{→}$HOCH2CH=CHCH2OH+2NaBr;
(4)B为HOCH2CH=CHCH2OH,物质B的同分异构体中既含有羟基,又含有醛基的同分异构体为HOCH2CH2CH2CHO、CH3CHOHCH2CHO、CH3CH2CHOHCHO、HOCH2CH(CH3)CHO、(CH3)2COHCHO,共有5种,
故答案为:5;
(5) 一定条件下形成聚合物的结构简式为
一定条件下形成聚合物的结构简式为 ,故答案为:
,故答案为: .
.
点评 本题考查有机推断与合成,为高频考点,是对有机化合物知识的综合考查,利用转化关系的反应条件及有机物结构、以信息的形式给出中学未学习的反应等进行推理推断是解题的关键,能较好的考查考生的阅读、自学能力和思维能力,清楚成键与断键位置是解决该类型题目的关键,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 物质的量浓度和体积都相同的盐酸和醋酸溶液,在与足量锌反应时,起始时二者产生H2速率基本相等 | |
| B. | 100mL1mol•L-1的盐酸和50mL2mol•L-1的盐酸,分别与足量的锌反应时,两者放出H2速率和质量均相等 | |
| C. | 100mLpH=3的H2SO4和HCl溶液,与足量锌反应后,放出H2的质量相等 | |
| D. | 100mLpH=3的盐酸与醋酸溶液,与足量锌反应后,所得H2的质量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,3-二甲基丁烷 | B. | 2-甲基-4-乙基-1-己烯 | ||
| C. | 3-甲基-1-丁烯 | D. | 3,3-二甲基-2-戊烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | H2R是二元弱酸,其Kal=1×10-2 | |
| B. | 当溶液恰好呈中性时,c(Na+)=2c(R2-)+c(HR-) | |
| C. | NaHR在溶液中水解倾向大于电离倾向 | |
| D. | 含Na2R与NaHR各0.1mol的混合溶液的pH=7.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,Ksp(CaCO3)=2.8×10-9 | |
| B. | 加入Na2CO3溶液的过程中,先生成CaCO3沉淀 | |
| C. | 滤液M中c(Cl-)>c(Na+)>c(Mg2+)>c(CO32-)>c(OH-) | |
| D. | 滤液M中$\frac{c(C{a}^{2+})}{c(M{g}^{2+})}$=$\frac{{K}_{sp}(CaC{O}_{3})}{{K}_{sp}(MgC{O}_{3})}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们可能是不同的分子 | B. | 它们可能是不同的离子 | ||
| C. | 它们可能互为同位素 | D. | 它们可能是分子和离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R是第三周期元素 | |
| B. | R元素的最高正价与N元素最高正价相同 | |
| C. | RO3-和NO3-均只能被还原,不能被氧化 | |
| D. | R和N两元素的单质都是空气的主要成分 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com