
| A. | HCl和盐酸 | B. | 干冰和CO2 | C. | 正丁烷和异丁烷 | D. | 白磷和红磷 |
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式:CH2CH2 | B. | N2的结构式:N≡N | ||
| C. | Na的原子结构示意图: | D. | CH4分子的比例模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
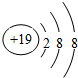
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3溶液中:K+、OH-、SO42-、SCN- | |
| B. | 使酚酞试液变红的溶液中:NH4+、Na+、HCO3-、NO3- | |
| C. | c(OH-)=1mol/L的溶液中:Na+、K+、CO32-、NO3- | |
| D. | c(H+)=1mol/L的溶液中:K+、Na+、Fe2+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 锌的质量(g) | 锌的形状 | 温度(℃) | 溶解于酸花的时间(s) | |
| A | 2 | 薄片 | 5 | 400 |
| B | 2 | 薄片 | 15 | 200 |
| C | 2 | 薄片 | 25 | 100 |
| D | 2 | 薄片 | 35 | 50 |
| E | 2 | 薄片 | 45 | 25 |
| F | 2 | 粉末 | 15 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Mg、Al、S的还原性依次增强 | |
| B. | O、S、Na、K的原子半径依次增大 | |
| C. | H2S、PH3、HCl、HF的热稳定性依次增强 | |
| D. | Mg(OH)2、Al(OH)3、KOH、Ca(OH)2的碱性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
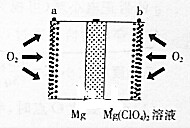 镁空气电池具有比锂电池更好的安全性和更低的成本,主要用于备用电源、军事应用,其工作原理如图所示.下列说法错误的是( )
镁空气电池具有比锂电池更好的安全性和更低的成本,主要用于备用电源、军事应用,其工作原理如图所示.下列说法错误的是( )| A. | 放电时Mg在负极被ClO4-氧化 | |
| B. | 正极的电极反应为:O2+2H2O+4e-═4OH- | |
| C. | 电池总反应为2Mg+O2+2H2O═2Mg(OH)2 | |
| D. | 理论上外电路流过1mol电子时电池总质量增加8.0g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
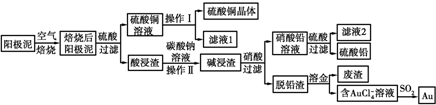
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com