
| A. | 80ml 0.1 mol•L-1NaCl溶液 | B. | 50ml 0.1 mol•L-1MgSO4溶液 | ||
| C. | 100ml 0.1 mol•L-1氨水 | D. | 0.1 mol固体氯化钠 |
分析 溶液的导电性强弱取决于溶液离子浓度大小、离子的电荷,溶液离子浓度越大、电荷越高,导电性越强.
解答 解:A、0.1mol•L-1NaCl溶液中,钠离子和氯离子浓度分别是0.1mol•L-1、0.1mol•L-1;
B、0.1mol•L-1MgSO4溶液中,镁离子和硫酸根离子的浓度分别是0.1mol•L-1、0.1mol•L-1,
C、0.1 mol•L-1氨水中,铵根离子和氢氧根离子的浓度分别为:小于0.1mol•L-1、小于0.1mol•L-1;
D、晶体中离子在静电作用的束缚下不能自由移动,所以不导电;
所以自由移动离子浓度最大、电荷浓度最大的是B,即B中导电性最强.
故选B.
点评 本题考查电解质溶液的导电性,题目难度不大,注意溶液的导电性强弱取决于溶液离子浓度大小和离子的电荷,把握电解质强弱的判断.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
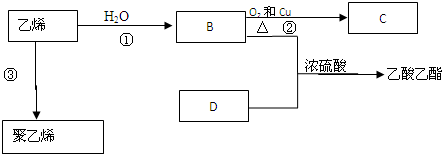
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶有SO2的溶液体积 | 饱和碘水体积 | 指示剂 | |
| 第一次 | 25.00mL | 6.05 | 2~3滴淀粉 |
| 第二次 | 25.00mL | 7.20 | 2~3滴淀粉 |
| 第三次 | 25.00mL | 5.95 | 2~3滴淀粉 |
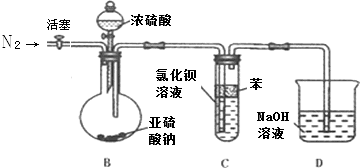
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1H和3H是不同的核素 | |
| B. | 1H、2H、3H、H+和H2是氢元素的五种不同粒子 | |
| C. | 12C和14C互为同位素,物理性质不同,但化学性质几乎完全相同 | |
| D. | 石墨和金刚石互为同位素,化学性质相似 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有的盐在水溶液中都能水解 | |
| B. | 盐类水解一定都显酸性或碱性 | |
| C. | 盐类的水解反应是酸碱中和反应的逆反应,因此盐类水解是吸热反应 | |
| D. | 盐类水解抑制了水的电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
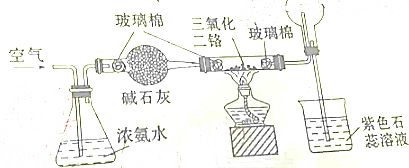
| A. | 烧杯中的紫色石蕊溶液不变色 | |
| B. | 圆底烧瓶中的气体一定为无色 | |
| C. | 加热后,通过三氯化二铬的气体由无色变为红棕色 | |
| D. | 三氯化二铬起氧化剂的作用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com