

分析 (1)根据盖斯定律,反应②×2-③即得,确定反应④2CO(g)+2NO(g)?N2(g)+2CO2(g),据此计算焓变;
(2)根据反应①的方程式得出Kp=$\frac{{P}^{2}(NO)}{P({N}_{2})P({O}_{2})}$;
(3)化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断,得出正确结论(4)根据该反应为气体体积减小的放热反应结合△G=△H-T△S<0自发判断;
(5)根据图象分析,常压下NO的转化率已经较高,并且高压转化率增加不大,但增加成本较大,据此分析;
(6)①温度一定,随反应物NO、CO的起始物质的量比增大,X-Y反应正向进行,一氧化碳的转化率X<Y,Y-Z平衡正向进行,一氧化氮增大会提高一氧化碳的转化率,则Y<Z;
②根据图象1分析,温度越低NO的平衡转化率越大,说明该反应为放热反应,所以温度越低,平衡时二氧化碳的体积分数也越大,据此画图.
解答 解:(1)根据盖斯定律,反应②×2-③即得,确定反应④2CO(g)+2NO(g)?N2(g)+2CO2(g)△H4=(2c-a)KJ/mol,故答案为:2c-a;
(2)根据反应①的方程式得出Kp=$\frac{{P}^{2}(NO)}{P({N}_{2})P({O}_{2})}$,故答案为:$\frac{{P}^{2}(NO)}{P({N}_{2})P({O}_{2})}$;
(3)A.单位时间内生成1mol NO2的同时消耗了lmol NO,都是正反应,故不能说明达到平衡状态,故A错误;
B.密度=$\frac{总质量}{体积}$,总质量一定,体积一定,故密度一定,故混合气体的密质不再发生改变不能说明达到平衡状态,故B错误;
C.混合气体的平均相对分子质量不再改变,说明物质的量不变,能说明达到平衡状态,故C正确;
D.在恒温恒压的容器中,NO的体积分数保持不变,则反应达平衡,能说明达到平衡状态,故D正确;
故选:CD;
(4)因为该反应为气体体积减小的放热反应,即△H<0,△S<0,所以在高温下△G=△H-T△S>0非自发,
故答案为:因为该反应为气体体积减小的放热反应,即△H<0,△S<0;
(5)根据图象分析,常压下NO的转化率已经较高,并且高压转化率增加不大,但增加成本较大,故答案为:常压下NO的转化率已经较高,并且高压要增加成本;
(6)①温度一定,随反应物NO、CO的起始物质的量比增大,X-Y反应正向进行,一氧化碳的转化率X<Y,Y-Z平衡正向进行,一氧化氮增大会提高一氧化碳的转化率,则Y<Z,X、Y、Z三点,CO的转化率的从大到小的顺序Z>Y>X,
故答案为:Z>Y>X;
②根据图象1分析,温度越低NO的平衡转化率越大,说明该反应为放热反应,所以温度越低,平衡时二氧化碳的体积分数也越大,又T2<T1,所以温度为T2时的变化趋势曲线为: ,故答案为:
,故答案为: .
.
点评 本题考查了盖斯定律计算,化学反应速率、平衡常数概念理解和计算应用,图象分析方法,反应自发进行的判断依据是关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 为了使婴儿对食品有更浓厚的兴趣,应在婴儿食品中加入大量的着色剂 | |
| B. | 为了使火腿肠颜色更鲜红,可多加入一些亚硝酸钠 | |
| C. | 蛋白质属于酸性食物 | |
| D. | 常用的抗酸药有氢氧化钠、氢氧化铝、碳酸钙等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 要证明硫酸亚铁铵晶体中含有NH4+,可以取少量晶体溶于水,加入足量NaOH浓溶液并加热,再用湿润的蓝色石蕊试纸检验产生的气体 | |
| B. | KClO3、KNO3、KMnO4等强氧化剂或其混合物不能研磨,否则将引起爆炸 | |
| C. | 常温下用pH试纸分别测定0.1mol•L-1NaClO溶液和0.01mol•L-1NaClO溶液的pH,可以比较浓度对水解程度的影响 | |
| D. | 过滤、结晶、灼烧、萃取、分液和蒸馏等都是常用的分离有机混合物的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由乙烯、氢气制取乙烷,由乙烷、溴(气体)制溴乙烷 | |
| B. | 乙烯使溴水褪色,乙炔使酸性高锰酸钾水溶液褪色 | |
| C. | 乙醇、乙酸制乙酸乙酯,由甘氨酸制得二肽 | |
| D. | 由乙烯制取聚乙烯,由甲醛、苯酚制取酚醛树脂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的焓变为正值 | |
| B. | 恒温恒容下,充入N2,平衡不移动 | |
| C. | 升高温度,逆反应速率增大 | |
| D. | 该反应化学方程式为CO+H2O$?_{高温}^{催化剂}$CO2+H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


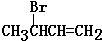 .
. (注明反应条件).在碱性条件下,由Ⅳ与
(注明反应条件).在碱性条件下,由Ⅳ与 反应合成Ⅱ,其反应类型为取代反应.
反应合成Ⅱ,其反应类型为取代反应. (写出其中一种).
(写出其中一种).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| a | |||||||
| d | f | g | |||||
| b | c | e | h | ||||
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com