
【题目】在不同浓度(c)、温度(T)条件下,蔗糖水解的瞬时速率如下表数据所示,下列判断不正确的是

A. a=6.00
B. 不同温度、不同蔗糖初始浓度的条件下,v可能相同
C. 318.2<b<328.2
D. 不同温度时,蔗糖浓度减少一半所需的时间相同
 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案科目:高中化学 来源: 题型:
【题目】某二元酸(化学式用H2B表示)在水中的电离方程式是H2B===H++HB-;HB-![]() H++B2-。回答下列问题。
H++B2-。回答下列问题。
(1)Na2B溶液显_____(填“酸性”、“中性”或“碱性”),理由是_______(用离子方程式表示)。
(2)在0.1 mol·L-1的Na2B溶液中,下列粒子浓度关系式正确的是____。
A.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
B.c(Na+)+c(OH-)=c(H+)+c(HB-)
C.c(Na+)+c(H+)=c(OH-)+c(HB-)+2c(B2-)
D.c(Na+)=2c(B2-)+2c(HB-)
(3)已知0.1 mol·L-1 NaHB溶液的pH=2,则0.1 mol·L-1 H2B溶液中的氢离子的物质的量浓度可能____0.11 mol·L-1(填“<”、“>”或“=”),理由是_____。
(4)0.1 mol·L-1 NaHB溶液中各种离子浓度由大到小的顺序是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 钠和钾的合金可用于快中子反应堆作热交换剂
B. 可用超纯硅制造的单晶硅来制造芯片
C. 电解饱和食盐水可制得黄绿色的氯气
D. 氯气有毒,不能用于药物的合成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种光化学电池的结构如图,当光照在表面涂有氯化银的银片上时,AgCl(s) =Ag(s)+Cl(AgCl) [Cl(AgCl)表示生成的氯原子吸附在氯化银表面],接着 Cl(AgCl)+e-→Cl-(aq),若将光源移除,电池会立即恢复至初始状态。下列说法正确的是

A. 光照时,电流由 铂流向银
B. 光照时,Pt 电极发生的反应为 2Cl-+2e-= Cl2
C. 光照时,Cl-向 Ag 电极移动
D. 光照时,电池总反应:AgCl (s)+Cu+(aq)=Ag(s)+Cu2+(aq)+Cl-(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X溶液中可能含有下列8种离子中的几种:Fe3+、Fe2+、Na+、NH4+、CO32、Cl、SO32、SO42。某同学为确定其成分,设计并完成以下实验(不考虑水解,所加试剂均足量):

下列说法正确的是
A. X溶液中一定存在Na+、SO32、SO42、CO32
B. X溶液中一定存在NH4+、Na+、SO42,至少含有Fe3+、Fe2+离子中的一种
C. 取少量X溶液,先加入适量氯水,再加少量KSCN溶液,若溶液呈血红色,则含有Fe2+
D. X溶液中一定含有Cl,且c(Cl)≥0.1mol·L1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用盖斯定律解答下列各小题
(1)已知反应:H2(g)+ ![]() O2(g)═H2O(g)△H1N2(g)+2O2═2NO2(g)△H2
O2(g)═H2O(g)△H1N2(g)+2O2═2NO2(g)△H2![]() N2(g)+
N2(g)+ ![]() H2(g)═NH3(g)△H3
H2(g)═NH3(g)△H3
利用上述三个反应,计算4NH3(g)+7O2(g)═4NO2(g)+6H2O(g)的反应焓变为(用含△H1、△H2、△H3的式子表示).
(2)已知:CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.2kJmol﹣1CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=+247.4kJmol﹣1
则以甲烷为原料制取氢气是工业上常用的制氢方法.CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:

(1)写出该反应的化学方程式________________________________。
(2)计算反应开始到10s,用X表示的反应速率是______________。
(3)下列叙述中能说明上述反应达到平衡状态的是______________。
a.当X与Y的反应速率之比为1:1
b.混合气体中X的质量分数保持不变
c.X、Y、Z的浓度之比为1:1:2
(4)当反应达到平衡时,用Y表示的正反应速率v正(Y)与用Z表示的逆反应速率v逆(Z)的关系式是_________________。
(5)为使该反应的反应速率增大,可采取的措施是_______。
a.适当降低温度 b.扩大容器的体积 c.充入一定量Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如图1: 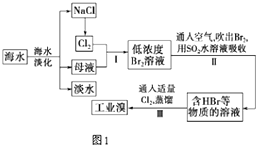
(1)请列举海水淡化的两种方法:、 .
(2)步骤I中己获得Br2 , 步骤II中又将Br2还原为Br﹣ . 其目的是 .
(3)步骤II用SO2水溶液吸收Br2 , 吸收率可达95%.有关反应的离子方程式为 .
(4)某化学研究性学习小组为了了解从工业溴中提纯溴的方法.查阅了有关资料知:Br2的沸点为59℃.微溶于水,有毒并有强腐蚀性.他们参观生产过程后.画了如图2装置简图: 
请你参与分析讨论:
①图中仪器B的名称是 .
②整套实验装皿中仪器连接均不能用橡胶塞和橡胶管.其原因是 .
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件? .
④C中液体颜色为 . 为除去该产物中仍残留的少量Cl2 , 可向其中加入NaBr,溶液,充分反应后.再进行的分离操作是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com