
| 选项 | 溶液 | 操作及现象 |
| A | Ca(OH)2溶液 | 通入CO2,溶液变浑浊.继续通CO2至过量,浑浊消失.再加入足量NaOH溶液,又变浑浊. |
| B | 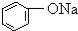 溶液 溶液 | 通入CO2,溶液变浑浊.继续通CO2至过量,浑浊消失. |
| C | Ca(ClO)2溶液 | 通入CO2,溶液没有明显变化.再滴入品红溶液,红色褪去. |
| D | CaCl2溶液 | 通入CO2,溶液没有明显变化.若同时通入CO2和NH3,则溶液变浑浊. |
| A. | A | B. | B | C. | C | D. | D |
分析 A.根据氢氧化钙和碳酸钙以及碳酸氢钙的化学性质来解答;
B.苯酚高于65℃与水混溶,室温时溶解度较小,碳酸的酸性大于苯酚的酸性,苯酚的酸性强于碳酸氢根离子,所以苯酚钠和二氧化碳和水反应生成碳酸氢钠和苯酚;
C.碳酸酸性强于次氯酸,碳酸钙在过量二氧化碳存在下会转化为碳酸氢钙,次氯酸具有强氧化性,可使品红褪色;
D.盐酸酸性强于碳酸,CaCl2溶液与CO2不反应,CaCl2溶液与氨气、二氧化碳反应生成碳酸钙沉淀.
解答 解:A.氢氧化钙中通二氧化碳会生成碳酸钙沉淀和水,继续通CO2至过量,碳酸钙和二氧化碳和水反应,碳酸钙沉淀再转化为易溶于水的碳酸氢钙,碳酸氢钙和氢氧化钠反应会生成碳酸钙沉淀,又变浑浊,故A正确;
B.65℃以上苯酚易溶于水,室温下苯酚的溶解度较小,苯酚钠和二氧化碳反应生成难溶性的苯酚和碳酸氢钠,溶液变浑浊,继续通CO2至过量,苯酚、碳酸氢钠和过量的二氧化碳不反应,溶液仍浑浊,故B错误;
C.向Ca(ClO)2溶液中通入二氧化碳,会生成碳酸钙和次氯酸,碳酸钙在过量二氧化碳存在下会转化为碳酸氢钙,沉淀消失,次氯酸具有强氧化性,可使品红褪色,故C正确;
D.CaCl2溶液与CO2不反应,若同时通入CO2和NH3,在碱性条件下,CaCl2溶液与氨气、二氧化碳反应生成碳酸钙沉淀,溶液变浑浊,故D正确.
故选B.
点评 本题考查物质的鉴别和检验,题目难度中等,解答本题的关键是把握相关物质的性质,易错点为B,注意65℃以上苯酚易溶于水,苯酚的酸性强于碳酸氢根离子,苯酚钠和二氧化碳和水反应生成碳酸氢钠和苯酚.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 1/5C2H2(g)+1/2O2(g)=2/5CO2(g)+1/5H2O(l)△H=+259.92 kJ/mol | |
| B. | 0.2C2H2(g)+0.5O2(g)=0.4CO2(g)+0.2H2O(l)△H=-259.92 kJ/mol | |
| C. | 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H=+2599.2 kJ/mol | |
| D. | 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(g)△H=-2599.2 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 实验序号 | 盐酸标准液体积(mL) | 所消耗氢氧化钠标准液的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.70 |
| 2 | 20.00 | 2.00 | 22.00 |
| 3 | 20.00 | 1.00 | 20.80 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 | |
| B. | 在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素 | |
| C. | 在金属元素区域可以寻找制备新型农药材料的元素 | |
| D. | 元素周期表是元素周期律的具体表现形式 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 第一份 | 第二份 | 第三份 | |
| 样品的质量/g | 7.54 | 15.08 | 35.00 |
| 二氧化硫的体积/L | 0.672 | 1.344 | 2.688 |
| 硫的质量/g | 0.8 | 1.6 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化锰是催化剂,能加快反应速率 | |
| B. | 温度越高,催化剂的催化效果越好 | |
| C. | 食品包装袋中的抗氧化剂就是“负催化剂”,能使氧化还原反应的速率减慢 | |
| D. | 升高温度,吸热反应和放热反应的反应速率都加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
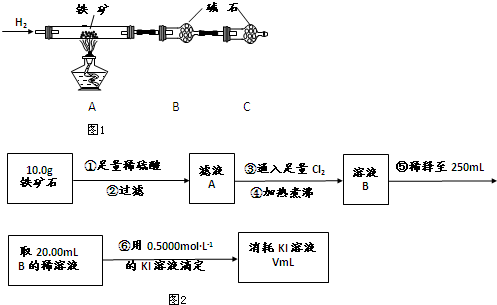
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com