
| A. | 2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O | |
| B. | 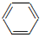 +HO-Na2$→_{60℃}^{浓硫酸}$ +HO-Na2$→_{60℃}^{浓硫酸}$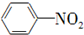 +H2O +H2O | |
| C. | CH2═CH2+H2O$\stackrel{催化剂}{→}$CH3-CH2OH | |
| D. | CH3COOCH2CH3+NaOH$\stackrel{△}{→}$CH3COONa+CH3CH2OH |
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:解答题
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
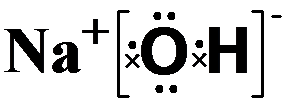 ,属离子化合物(填“离子”或“共价”).
,属离子化合物(填“离子”或“共价”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L NaHCO3溶液,c(Na+)>c(OH-)>c(HCO3-)>c(H+) | |
| B. | 0.1mol/L K2S溶液中,c(K+)=c(S2-)+c(HS-)+c(H2S) | |
| C. | 常温时pH=2的盐酸和pH=12的氨水中由水电离出的c(H+)相等 | |
| D. | pH=3的盐酸和pH=11的氨水等体积混合完全反应后c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
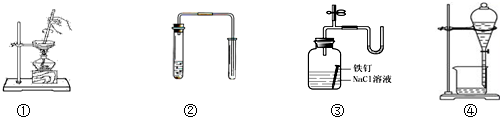
| A. | 装置①可用于加热蒸干氯化铵溶液得到氯化铵晶体 | |
| B. | 装置②可用于铜和稀硝酸制取并收集少量NO | |
| C. | 装置③可用于证明铁生锈氧气参与反应 | |
| D. | 苯萃取碘水中的碘后,从装置④下口放出的是碘的苯溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 | |
| B. | 温度一定时,向水中滴加少量酸或碱形成稀溶液,水的离子积常数Kw变小 | |
| C. | 常温下,2NO(g)+O2(g)═2NO2(g)能够自发进行,则该反应的△H<0 | |
| D. | 由于Ksp(BaSO4)<Ksp(BaCO3),因此不可能使BaSO4沉淀转化为BaCO3沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 研究目的 | 温度(T) 对反应的影响 | 压强(p)对平衡常数的影响 | 压强(p)对反应的影响(p2>p1) | 温度(T)对反应的影响(T1>T2) |
| 图示 | 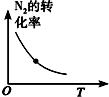 | 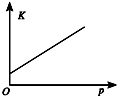 | 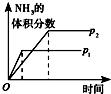 |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
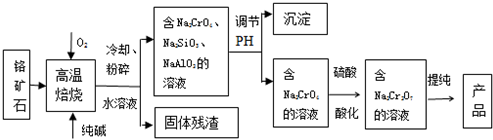
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com