
| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:
 某种兴奋剂的结构简式如图:回答下列问题:
某种兴奋剂的结构简式如图:回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| ||

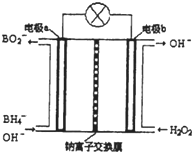
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、农作物收获后,就地焚烧秸秆,增加土壤中钾肥含量 |
| B、厨房中燃气泄漏,立即打开抽油烟机排气 |
| C、硝酸是重要的工业原料,可用于制造炸药 |
| D、高纯硅可用于制作光导纤维,光导纤维遇强碱会“断路” |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某研究性学习小组的课题为“Mg-C原电池电解KI-淀粉溶液的研究”,他们的研究装置如右图.有关说法不正确的是( )
某研究性学习小组的课题为“Mg-C原电池电解KI-淀粉溶液的研究”,他们的研究装置如右图.有关说法不正确的是( )| A、镁为负极 |
| B、原电池中碳极的电极反应为:Fe3++e-═Fe2+ |
| C、电解池中阳极处先变红 |
| D、电解池中阴极的电极反应式为:2H++2e-═H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径C>D>A>B |
| B、原子序数b>a>d>c |
| C、单质的还原性A>B>C>D |
| D、离子半径D>C>A>B |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(OH-) |
| c(H+) |
| A、该一元酸溶液的pH=1 | ||
| B、该溶液中HA的电离度为1% | ||
| C、该溶液中水的离子积常数为1×10-22 | ||
D、若加水稀释,则
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com