
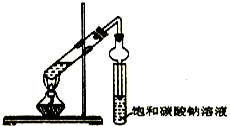
 某同学用下列所示实验装置制取乙酸乙酯.回答以下问题:
某同学用下列所示实验装置制取乙酸乙酯.回答以下问题:分析 (1)乙醇、乙酸在浓硫酸做催化剂,吸水剂条件下加热反应生成乙酸乙酯,浓硫酸密度大,稀释产生大量的热,混合时应将浓硫酸加入到乙醇中,以防酸液飞溅,乙酸易挥发,冷却后再加入乙酸;
(2)乙酸和乙醇易溶于水,导管口在饱和碳酸钠溶液液面上,而不插入液面下是为了防止倒吸,球形干燥管导气的同时也起到冷凝、防倒吸作用;
(3)根据NaOH能与酸、酯发生反应以及NaOH量的不同反应进行的程度不同.
解答 解:(1)乙醇、乙酸在浓硫酸做催化剂,吸水剂条件下加热反应生成乙酸乙酯,浓硫酸密度大,稀释时放出大量的热,所以应将浓硫酸加入到乙醇中,以防酸液飞溅,乙酸易挥发,冷却后再加入乙酸;添加顺序依次乙醇、浓硫酸、乙酸;
故答案为:乙醇 浓H2SO4;
(2)乙酸和乙醇易溶于水,不插入液面下是为了防止倒吸,球形干燥管导气的同时也起到防倒吸作用,
故答案为:防倒吸;
(3)①甲得到了不溶于水的中性酯,没有酸,说明所加NaOH溶液恰好中和了过量的酸,
故答案为:适量;
②乙得到显酸性的酯的混合物,酸有剩余,说明是所加NaOH溶液不足未将酸完全反应,
故答案为:少量;
③丙得到大量水溶性物质,说明没有酯,是因为所加NaOH溶液过量,酯发生水解,
故答案为:过量.
点评 本题考查乙酸乙酯的制备,明确制备原理及实验装置特点是解题关键,注意实验的基本操作以及浓硫酸混合时的注意事项,易错点是球形干燥管的用途,培养了学生分析问题和解决问题的能力.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源:2016-2017学年宁夏卫一高一上10月月考化学a卷(解析版) 题型:选择题
30ml 5mol/LNaOH溶液中NaOH的质量为
A.4g B.5g C.6g D.7g
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
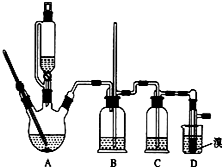 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
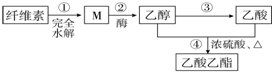
| A. | ③和④都发生了氧化还原反应 | |
| B. | M虽然分子结构中无醛基,但仍然可以发生银镜反应 | |
| C. | 步骤②,1molM完全反应可以生成3mol乙醇 | |
| D. | 若用淀粉替代纤维素,一定条件下也能按照此路线制备乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
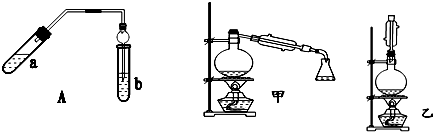
| 实验编号 | 试管a中试剂 | 试管b中试剂 | 测得有机层的厚度/cm |
| A | 3mL乙醇、2mL乙酸、1mL18mol•L-1 浓硫酸 | 饱和Na2CO3溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 | |
| C | 3mL乙醇、2mL乙酸、6mL 3mol•L-1 H2SO4 | 1.2 | |
| D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com