
| A、常温常压下,48g O2和O3组成的混和气体中所含的氧原子数为3NA |
| B、2mol H2O中含有36NA个电子 |
| C、2L 0.1mol?L-1 H2SO4溶液中含有0.2NA个H+ |
| D、常温常压下,22.4L CH4中含有NA个CH4分子 |


 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:
| A、PM2.5表面积大能吸附大量的有毒、有害物质 |
| B、PM2.5在空气中一定能形成气溶胶 |
| C、与较粗的大气颗粒物相比,PM2.5对人体健康和大气环境质量的影响更大 |
| D、秸秆燃烧、煤炭燃烧、汽车尾气的排放等都与PM2.5的形成有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合溶液中c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-) | ||
| B、混合溶液中c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-) | ||
| C、加入AgNO3溶液时首先生成AgCl沉淀 | ||
D、混合溶液中
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯的分子是环状结构,其性质跟环烷烃相似 |
B、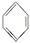 表示苯的分子结构,其中含有碳碳双键,因此苯的性质跟烯烃相同 表示苯的分子结构,其中含有碳碳双键,因此苯的性质跟烯烃相同 |
| C、苯的分子式是C6H6,分子中的C原子远没有饱和,因此能使溴水褪色 |
| D、苯环上的碳碳键的键能、键长介于单双键之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Z的分解速率和生成速率相等 |
| B、X、Y、Z的浓度比为1:3:2 |
| C、反应体系的总质量保持不变 |
| D、单位时间内生成n mol Z,同时生成n mol X |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L Cl2完全溶于水时,转移电子数为NA |
| B、常温下,pH=1的H2SO4溶液中含有的H+的数目为0.1NA |
| C、标准状况下,2.24L SO3中含有硫原子的数目为NA |
| D、常温下,23g NO2和N2O4的混合气体中含有NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O与Na2O2均可与盐酸反应,故二者皆为碱性氧化物 |
| B、Na2O与Na2O2在一定条件下可以相互转化 |
| C、Na2O与H2O反应为化合反应,Na2O2是白色固体,与H2O作用放出O2,生成NaOH |
| D、在呼吸面具中,Na2O2常作供氧剂,而Na2O不能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
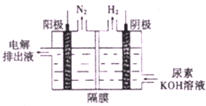 氢气是一种清洁能源,氢气的制取与利用是氢能源领域的研究热点
氢气是一种清洁能源,氢气的制取与利用是氢能源领域的研究热点查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com