
��֪��ѧ��Ӧ�٣�Fe(s)��CO2(g)��FeO(s)��CO(g)����ƽ�ⳣ��ΪK1��
��ѧ��Ӧ�ڣ�Fe(s)��H2O(g)��FeO(s)��H2(g)����ƽ�ⳣ��K2��
���¶�973 K��1173 K����£�K1��K2��ֵ�ֱ����£�
(1)ͨ�������е���ֵ�����ƶϣ���Ӧ����________(����ȡ����ȡ�)��Ӧ��
(2)���з�Ӧ�ۣ�CO2(g)��H2(g)��CO(g)��H2O(g)������д���÷�Ӧ��ƽ�ⳣ��K3����ѧ����ʽ��K3��________��
(3)���ݷ�Ӧ����ڿ��Ƶ���K1��K2��K3֮��Ĺ�ϵʽ________���ݴ˹�ϵʽ���ϱ����ݣ�Ҳ���ƶϳ���Ӧ����________(����ȡ����ȡ�)��Ӧ��Ҫʹ��Ӧ����һ�������½�����ƽ��������Ӧ�����ƶ����ɲ�ȡ�Ĵ�ʩ��________(��д���)��
A����С��Ӧ�����ݻ�
B������Ӧ�����ݻ�
C�������¶�
D�������¶�
E��ʹ�ú��ʵĴ���
F���跨����CO��Ũ��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 2NH3�ǹ�ҵ�Ϻϳɰ�����Ҫ��Ӧ��
2NH3�ǹ�ҵ�Ϻϳɰ�����Ҫ��Ӧ��
 2NH3��g����H=2��E1-E3����-2��E3-E1��kg/mol
2NH3��g����H=2��E1-E3����-2��E3-E1��kg/mol 2NH3��g����H=2��E1-E3����-2��E3-E1��kg/mol
2NH3��g����H=2��E1-E3����-2��E3-E1��kg/mol| 16 |
| a2 |
| 16 |
| a2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �¶� | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
| [CO][H2O] |
| [H2][CO2] |
| [CO][H2O] |
| [H2][CO2] |
| K1 |
| K2 |
| K1 |
| K2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �¶� | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014���㽭�ٺ��и�һ��ѧ����ĩģ�⻯ѧ�Ծ��������棩 ���ͣ������
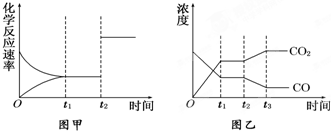
��8�֣�ij�о���ѧϰС��Ϊ̽�����������ᷴӦ��ȡͬ������ͬ�����пƬ��ͬŨ��������������ƽ��ʵ�飺
ʵ��٣��Ѵ���ƬͶ�뵽ʢ��ϡ������Թ��У������������������ʱ仯��ͼ��ʾ��
ʵ��ڣ��������е��뼸��CuCl2��Һ�������������ʼӿ졣
�Իش��������⣺
��1���Է���ʵ�����t1��t2���ʱ仯����Ҫԭ���� �� ��t2��t3���ʱ仯����Ҫԭ���� ��
��2����Ҫ�ӿ컯ѧ��Ӧ���ʣ���ʵ��ڵķ����⣬�����Բ�ȡ��Щ��ʩ��������д���㣩
��
��3��ijͬѧ��Ϊʵ��ڷ�Ӧ���ʼӿ����Ҫԭ������Ϊ�γ���ԭ��أ�����Ϊ�Ƿ���ȷ��
�����ȷ������ȷ��������ѡ��������Ӧ��a��b����
a��������ȷ����˵��ԭ��
b������ȷ��д��ʵ�����ԭ��ص����������缫��Ӧʽ��
��4����֪�Ȼ�ѧ����ʽFe(S) + 2H+ (aq) = Fe2+(aq) + H2(g)�� ; ��H= ��42kJ/mol��28g������ȫ��Ӧ��ų�������Ϊ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com