
 某废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图,加热聚丙烯废塑料得到的产物如表:
某废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图,加热聚丙烯废塑料得到的产物如表:| 产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 碳 |
| 质量分数(%) | 12 | 24 | 12 | 16 | 20 | 10 | 6 |
 .
.分析 废塑料在强热条件下反应生成氢气、碳以及多种烃的混合物,其中B用于收集易液化的有机物,可得到苯、甲苯等,C用于检验烯烃,可吸收乙烯、丙烯等,用氢气、甲烷等可燃烧,
(1)碳化钙和水反应制取乙炔同时生成氢氧化钙;乙炔能发生加聚反应生成聚乙炔;
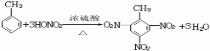
(2)甲苯可以使高锰酸钾褪色;甲苯可与浓硝酸在浓硫酸作用下发生取代反应生成三硝基甲苯;利用等效氢法找甲苯一氯代物的种类;
(3)产物中的乙烯、丙烯能与溴水发生加成反应,剩余气体为氢气、甲烷,根据摩尔质量在数值上等于相对分子质量,求出混合气体的平均相对分子质量;
(4)与乙烯互为同系物,相对分子质量在86以内,且与HBr加成产物只有一种结构,说明结构对称,且含有的C原子数小于$\frac{86}{14}$=6.14,可为4或6个C原子.
解答 解:(1)电石制备乙炔的方程式为:CaC2+2H2O=Ca(OH)2+C2H2↑;乙炔加聚生成聚乙炔的化学方程式为:nC2H2$\stackrel{一定条件}{→}$;
故答案为:CaC2+2H2O=Ca(OH)2+C2H2↑;nC2H2$\stackrel{一定条件}{→}$;
(2)试管B中含有苯和甲苯,苯不能使高锰酸钾褪色,甲苯可以使高锰酸钾褪色,
甲苯可与浓硝酸在浓硫酸作用下发生取代反应生成三硝基甲苯,反应的方程式为 ,
,
甲苯的等效氢有4种,一氯甲苯的同分异构体有4种: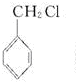
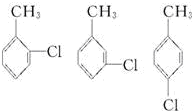 ,总计4种,
,总计4种,
故答案为:4; ;
;
(3)产物中的乙烯、丙烯分子中含有碳碳双键,能够与溴水发生反应,溴水褪色,设混合气体的质量为100g,则氢气的质量为12g,物质的量为6mol,甲烷的质量为24g,物质的量为1.5mol,混合气体的摩尔质量为:$\frac{12g+24g}{6mol+1.5mol}$=4.8g/mol,即均相对分子质量为4.8,
故答案为:棕黄色溶液变无色或褪色;4.8;
(4)与乙烯互为同系物,相对分子质量在86以内,且与HBr加成产物只有一种结构,说明结构对称,且含有的C原子数小于$\frac{86}{14}$=6.14,可为4或6个C原子,符合条件的单烯烃有:CH3CH=CHCH3、CH3CH2CH=CHCH2CH3、(CH3)2C=C(CH3)2,而常温下为液态,应为CH3CH2CH=CHCH2CH3、(CH3)2C=C(CH3)2,
故答案为:CH3CH2CH=CHCH2CH3;(CH3)2C=C(CH3)2.
点评 本题考查较综合,为高考常见题型,涉及有机物性质实验、有机物的合成、相关概念的辨析烯烃加成反应的规律以及同分异构体的书写,侧重考查学生思考问题的全面性,把握有机物中官能团与性质的关系为解答的关键,题目综合性强,但难度不大


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 g氢气所含原子数为NA | |
| B. | 常温常压下,1.06gNa2CO3含有的Na+离子数为0.02NA | |
| C. | 在常温常压下,11.2LN2所含原子数为NA | |
| D. | 2.7g金属铝和足量盐酸反应,失去的电子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 的说法不正确的是( )
的说法不正确的是( )| A. | 能与溴水发生加成反应 | B. | 分子中所有的碳原子在同一平面上 | ||
| C. | 能与碳酸氢钠发生反应 | D. | 能发生取代、氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠溶液与稀盐酸 | B. | 明矾溶液与氢氧化钠溶液 | ||
| C. | 碳酸氢钠溶液与稀盐酸 | D. | 偏铝酸钠溶液与稀盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com