
在一定温度下有甲、乙两容积相等的密闭容器(两容器容积保持不变)。
(1)向甲容器中通入3 mol N2和4 mol H2,反应达到平衡时,生成NH3 amol。此时,NH3的物质的量分数是_____________。(用含有“a”的表达式表示)。若在达到平衡状态的甲容器中通入少量的N2,则达到新平衡时,体系中N2的体积分数将_____________(选填“增大”、“减小”或“不变”)。
(2) 若起始时,向乙中通入6mol N2和8mol H2,达到平衡时,生成的NH3的物质的量为b mol,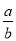
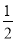 (选填“>”、“<”或“=”)。
(选填“>”、“<”或“=”)。
科目:高中化学 来源:2017届四川省高三12月月考化学试卷(解析版) 题型:填空题
科学家研究出一种以天然气为燃料的“燃烧前捕获系统”,其简单流程如图所示部分(条件及物质未标出)。
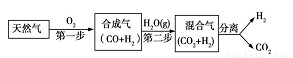
(1)已知:CH4、CO、H2的燃烧热分别为890.3 kJ·mol-1、283.0 kJ·mol-1、285.8 kJ·mol-1,则上述流程中第一步反应2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH= 。
(2)工业上可用H2和CO2制备甲醇,其反应为:CO2(g)+3H2(g) CH3OH(g)+H2O(g),某温度下,将1 mol CO2和3 mol H2充入体积不变的2 L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下:
CH3OH(g)+H2O(g),某温度下,将1 mol CO2和3 mol H2充入体积不变的2 L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下:
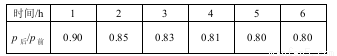
① 用H2 表示前2 h平均反应速率v(H2)= 。
② 该温度下CO2的平衡转化率为 。
(3)在300 ℃、8 MPa下,将二氧化碳和氢气按物质的量之比为1∶3通入一密闭容器中发生(2)中反应,达到平衡时,测得二氧化碳的平衡转化率为50%,则该反应条件下的平衡常数Kp= (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g) CH4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系:
CH4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系:
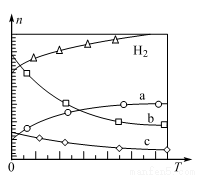
①该反应的ΔH 0(填“>”、“=”或“<”)。
②曲线c表示的物质为 。
③为提高H2的平衡转化率,除改变温度外,还可采取的措施是 ,用平衡移动原理说明理由 。
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上学期阶段考二化学试卷(解析版) 题型:选择题
用下图所示实验装置进行相应实验,能达到实验目的的是( )
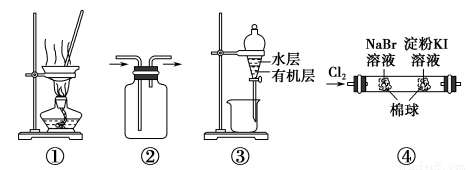
A.用图①所示装置,蒸干NH4Cl饱和溶液制备NH4Cl晶体
B.按装置②所示的气流方向可用于收集H2、NH3等
C.用图③所示装置,分离CCl4萃取I2水后的有机层和水层
D.用图④所示装置,可以证明氧化性:Cl2>Br2>I2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省湖州市高二上期中化学试卷(解析版) 题型:选择题
一定条件下,反应4NH3(g)+5O2(g)  4NO(g)+6H2O(g) △H =-a kJ·mol-1,在5 L密闭容器中进行,10 s时达到平衡,水蒸气的物质的量增加了0.6 mol,则下列说法正确的是( )
4NO(g)+6H2O(g) △H =-a kJ·mol-1,在5 L密闭容器中进行,10 s时达到平衡,水蒸气的物质的量增加了0.6 mol,则下列说法正确的是( )
A.第10s时,H2O的反应速率为0.012 mol·Lˉ1·sˉ1
B.10s内,NH3的平均反应速率为0.48 mol·Lˉ1·minˉ1
C.10s内,反应放出的热量为a kJ
D.这10s内,O2的反应速率逐渐减小,NO的反应速率逐渐增大
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省湖州市高二上期中化学试卷(解析版) 题型:选择题
向集满CO2的铝制易拉罐中加入过量NaOH浓溶液,立即封闭罐口,易拉罐渐渐凹瘪;再过一段时间,罐壁又重新凸起。上述实验过程中没有发生的离子反应是( )
A.Al3++4OH?=AlO2?+3H2O
B.Al2O3+2OH?=2AlO2?+H2O
C.2Al+2OH?+2H2O=2AlO2?+3H2↑
D.CO2+2OH?=CO32?+H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省慈溪市高二上学期期中化学试卷(解析版) 题型:选择题
某温度时,可逆反应:X(g)+Y(g) Z(g)的平衡常数K=1.0,若反应物的初始浓度c(X)=4 mol·L-1,c(Y)=a mol·L-1,达到平衡后c(Z)=2 mol·L-1。则a为( )
Z(g)的平衡常数K=1.0,若反应物的初始浓度c(X)=4 mol·L-1,c(Y)=a mol·L-1,达到平衡后c(Z)=2 mol·L-1。则a为( )
A.1 B.2 C.3 D.4
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省慈溪市高二上学期期中化学试卷(解析版) 题型:选择题
下列各组热化学方程式中,化学反应的ΔH前者大于后者的是  ( )
( )
①C(s)+O2(g)=CO2(g) ΔH1 C(s)+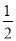 O2(
O2( g)=CO(g) ΔH2
g)=CO(g) ΔH2
②S(s)+O2(g)=SO2(g) ΔH3 S(g)+O2(g)=SO2(g) ΔH4
③H2(g)+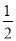 O2(g)=H2O(l) Δ
O2(g)=H2O(l) Δ H5 2H2(g)+O2(g)=2H2O(l) ΔH6
H5 2H2(g)+O2(g)=2H2O(l) ΔH6
④CaCO3(s)=CaO(s)+CO2(g) ΔH7 CaO(s)+H2O(l)=Ca(OH)2(s) ΔH8
A.① B.④ C.②③④ D.①②③
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上半期考试化学卷(解析版) 题型:填空题
I 已知,CO 的毒性表现在 CO 与血红蛋白(Hb)结合成 Hb·CO,使血红蛋白失去输送 O2 功能。CO 进入血液后有如下平衡:CO+Hb·O2 O2+Hb·CO,已知在人体体温 37℃下,该平衡常数为 220。试回答:
O2+Hb·CO,已知在人体体温 37℃下,该平衡常数为 220。试回答:
(1)煤气中毒病人,可以通过进入高压氧舱的方法来救治,请用化学平衡的原理加以说明:
(2)抽烟时,进入肺部的空气中 c(CO)=10-6mol/L,c(O2 )=10-2mol/L,则 c(Hb·CO)为 c(Hb·O2)的 倍。
(3)已知当血液中c(Hb·CO)/c(Hb·O2)的比值大于 0.02 时,人的智力会很快受到损伤,为避免人的智力受到损伤,c(O2)与 c(CO)的比值应大于___________。
II 在某一温度条件下, Bodensteins 研究了反应:2HI(g)  H2(g) +I2(g),气体混合物中 HI 的物质的量浓度 x(HI)与反应时间 t 的关系如下表:
H2(g) +I2(g),气体混合物中 HI 的物质的量浓度 x(HI)与反应时间 t 的关系如下表:
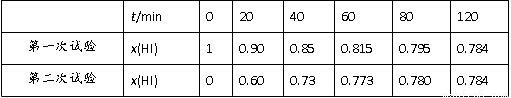
(4)根据上述实验结果,该反应的平衡常数K的计算式为_________。
(5)上述反应,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)×x(I2),其中k正、k逆为速率常数,则k逆为_________(以K和k正表示)。若k正=0.002·min-1,第一次实验时,当t=20min,v正=___________·min-1。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高二上期中化学试卷(解析版) 题型:选择题
下列措施能明显增大原反应的化学反应速率的是( )
A.Na与水反应时增大水的用量
B.将稀H2SO4改为98%的浓H2SO4与Zn反应制取H2
C.在H2SO4与NaOH两溶液反应时,增大压强
D.恒温恒容条件下,在工业合成氨反应中,增加氮气的量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com