
下列表格中的各种情况,可以用下面的图象曲线表示的是( )
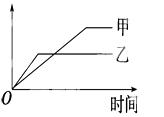
| 反应 | 纵坐标 | 甲 | 乙 | |
| A | 等质量的钾、钠分别与足量水反应 | H2质量 | 钠 | 钾 |
| B | 相同质量氨,在同一容器中2NH3 | 氨气的转化率 | 500℃ | 400℃ |
| C | 在体积可变的恒压容器中,体积比1:3的N2、H2,2NH3 | 氨气的浓度 | 活性高的催化剂 | 活性一般的催化剂 |
| D | 2molSO2与1molO2,在相同温度下2SO2+O2 | SO3物质的量 | 10个大气压 | 2个大气压 |
【知识点】钠钾性质 化学反应速率和化学平衡 C1 G1 G2
【答案解析】A 解析:A、根据金属钾和金属钠与水反应可知,2Na~H2,2K~H2,等质量钾、钠,则金属钠的物质的量大,所以金属钠产生的氢气多,金属钾的活泼性比金属钠强,所以金属钾的反应速率快,故A正确;
B、对于反应2NH3⇌N2+3H2,温度越高化学发应速率越快,所以甲达到化学平衡用的时间短,故B错误;
C、催化剂只能加快反应速率,不引起平衡移动,所以甲和乙达到化学平衡时,氨气的浓度相等,故C错误;
D、对于反应2SO2+O2⇌2SO3,增大压强化学平衡正向移动,所以达到平衡时,三氧化硫的量乙高于甲,故D错误.
【思路点拨】本题考查了钠钾性质,化学反应速率和化学平衡,注意拐点处的含义以及外界条件对化学反应速率和化学平衡的影响。


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述错误的是
A.K值不变,平衡可能移动 B.K值变化,平衡一定移动
C.平衡移动,K值可能不变 D.平衡移动,K值一定变化
查看答案和解析>>
科目:高中化学 来源: 题型:
葡萄糖酸钙是一种可促进骨骼生长的营养物质。葡萄糖酸钙可通过以下反应制得:
C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7+CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2↑
相关物质的溶解性见下表:
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水 易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可 |
实验流程如下:
C6H12O6溶液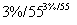


 悬浊液
悬浊液

 Ca(C6H11O7)2
Ca(C6H11O7)2
请回答下列问题:
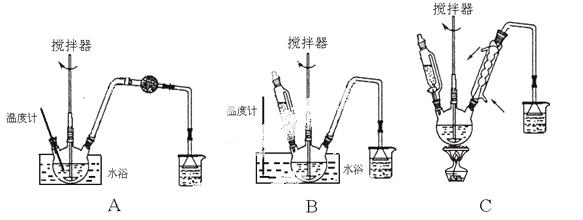
(1)第①步中溴水氧化葡萄糖时,下列装置最适合的是________。
制备葡萄糖酸钙 的过程中,葡萄糖的氧化也可用其它试剂,下列物质中最适合的是________。
的过程中,葡萄糖的氧化也可用其它试剂,下列物质中最适合的是________。
A.新制Cu(OH)2悬浊液 B.酸性KMnO4溶液
C.O2/葡萄糖氧化酶 D.[Ag(NH3)2]OH溶液
(2)第②步充分反应后CaCO3固体需有剩余,其目的是___________________________;本实验中不宜用CaCl2替代CaCO3,理由是________。
(3)第③步需趁热过滤,其原因是________。
(4)第④步加入乙醇的作用是________。
(5)第⑥步中,下列洗涤剂最合适的是________。
A.冷水 B.热水 C.乙醇 D.乙醇-水混合溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
在体积可变的密闭容器中,甲醇在浓硫酸的作用下发生如下反应:
2CH3OH(g) CH3OCH3(g)+H2O(g) △H=-25kJ·mol-1
CH3OCH3(g)+H2O(g) △H=-25kJ·mol-1
A. 2mol甲醇参加反应,放出的热量为25kJ
B. 浓硫酸在反应中只作催化剂
C. 2υ(CH3OH)=υ(CH3OCH3)
D. 升高温度或增大压强均可加快反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,对于可逆反应X(g)+3Y(g) 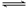 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3mol·L-1、0.08 mol·L-1,则下列判断正确的是
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3mol·L-1、0.08 mol·L-1,则下列判断正确的是
A.c1∶c2=3∶1
B.X、Y的转化率不相等
C.平衡时,Y和Z的生成速率之比为2∶3
D.c1的取值范围为0 mol·L-1<c1<0.14 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下在容积为 2L 的密闭容器中,发生反应 2X(g) + Y(g) 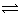 2W(g);△H<0,当充入 2 mol X 和 1 mol Y,经20 s达到平衡时生成了 0.4 molW。下列说法正确的是()
2W(g);△H<0,当充入 2 mol X 和 1 mol Y,经20 s达到平衡时生成了 0.4 molW。下列说法正确的是()
①升高温度,W 的体积分数减小,△H 增大
②以 Y 的浓度变化表示的反应速率为 0.01 mol/(L·s)
③在其它条件不变的情况下,增加 1 mol X ,则 X 和 Y 的转化率均提高
④增大压强,正反应速率增大,逆反应速率减小,则平衡向正反应方向移动
⑤再向容器中通入 2 mol X 和 1 mol Y,达到平衡时,X、Y 的转化率均增大。
A、①⑤ B、⑤ C、②③④ D、④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏伽德罗常数。下列说法正确的是( )
A.标准状况下,11.2L乙烯含有的极性共价键数为NA
B.常温下,5.6LNO和5.6LO2的混合气体中含有的分子数为0.5NA
C.16.9gBaO2固体中阴、阳离子总数为0.2NA
D.含有1molFe(OH)3的氢氧化铁胶体中含有胶粒数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M=Mn、Zn、Ni且均显+2价,下同)由铁酸盐(MFe2O4)经高温还原而得。常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:

(1)已知铁酸盐(MFe2O4)被H2高温还原时,发生反应的MFe2O4与H2的物质的量之比为 2︰1,则还原产物 MFe2Ox 中x=______,MFe2Ox 中+2价铁与+3价铁的量之比为_____。
(2)在酸性溶液中,Fe2O42-易转化为Fe2+:Fe2O42-+2e-+8H+→2Fe2++4H2O有 KMnO4、Na2CO3、Cu2O、Fe2(SO4)3 四种物质中的一种能使上述还原过程发生,写出该氧化还原反应的离子方程式并配平_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B两种 气体在一定条件发生反应:
气体在一定条件发生反应:
aA(g)+bB(g)cC(g)+dD(g)
取a mol A和b mol B置于容积为V L的容器内,1 min后,测得容器中A的浓度为x mol·L-1。则此时B的浓度为________,C的浓度为________,以A的浓度变化表示的反应速率为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com