
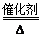 7N2+12H2O(NO也有类似的反应)
7N2+12H2O(NO也有类似的反应)| | 注意事项 | 理由 |
| ① | ______________ | ____________ |
| ② | ________________ | ____________ |
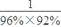 =1.13,所以制HNO3所用去的NH3的质量点总耗用NH3质量的百分比为
=1.13,所以制HNO3所用去的NH3的质量点总耗用NH3质量的百分比为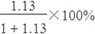 =53.1%。
=53.1%。

科目:高中化学 来源:不详 题型:实验题
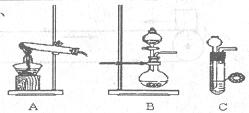
| | 实验装置 | 实验药品 | 制备原理 |
| 甲小组 | A | 氢氧化钙、氯化铵 | 反应的化学方程式为 ① |
| 乙小组 | ② | 浓氨水、氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用: ③ |
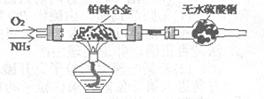
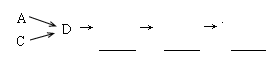
 3Cu+N2+3H2O),而氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水立即反应生成Mg(OH)2和NH3。乙组提出了如下制备氮化镁的实验方案示意框图(实验前系统内空气已排除;图中箭头表示气体的流向)。你认为此方案是否正确,并说明理由 。
3Cu+N2+3H2O),而氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水立即反应生成Mg(OH)2和NH3。乙组提出了如下制备氮化镁的实验方案示意框图(实验前系统内空气已排除;图中箭头表示气体的流向)。你认为此方案是否正确,并说明理由 。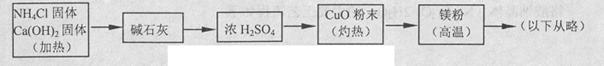
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
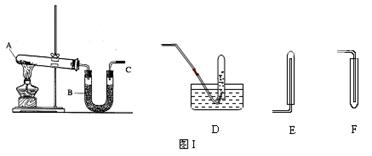
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
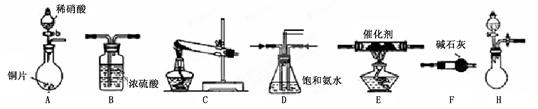
| 试剂组合序号 | 固体试剂 | NH3体积(mL) | |
| a | 6.0 g Ca(OH)2(过量) | 5.4 g NH4Cl | 1344 |
| b | 5.4g (NH4)2SO4 | 1364 | |
| c | 6.0 g NaOH(过量) | 5.4 g NH4Cl | 1568 |
| d | 5.4g (NH4)2SO4 | 1559 | |
| e | 6.0 g CaO(过量) | 5.4 g NH4Cl | 1753 |
| f | 5.4 g (NH4)2SO4 | 1792 | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
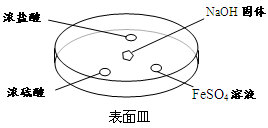
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
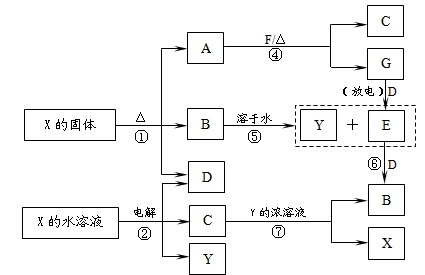
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液 |
| B.为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解 |
C.N2(g)+3H2(g) 2NH3(g) ΔH<0,其他条件不变时升高温度,平衡时氢气转化率增大 2NH3(g) ΔH<0,其他条件不变时升高温度,平衡时氢气转化率增大 |
| D.吸热反应“TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反应的ΔS<0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.5.76 | B.2.88 | C.1.44 | D.4.32 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com