
物质的量浓度都是0.1mol/L的CH3COOH和CH3COONa混合溶液,已知其中c(CH3COO-)>c(Na+),对该溶液的下列判断正确的是( )
A.c(H+)<c(OH-) B.c(CH3COOH)+c(CH3COO-)=0.2mol/L
C. c(CH3COOH) >c(CH3COO-) D. c(CH3COO-)+ c(OH-)=0. 1mol/L
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:
学好《化学与生活》,对形成更加科学的生活方式具有指导意义。
(1)据报道:目前世界有近20亿人口患缺铁性贫血,为了预防缺铁性贫血,专家建议最好使用___________。
A.铝锅 B.铁锅 C.钛合金锅 D.砂锅
(2)在减肥和预防减肥的方法中,不正确的是___________。
A.加强体育锻炼、养成体育锻炼的好习惯
B.合理、科学饮食,控制高脂肪、高糖类食品
C.在医生指导下服用减肥药物
D.少睡觉,长时间看书、看电视
(3)下列做法不会造成水污染的是___________。
A.生活污水任意排放 B.海上油轮原油泄漏
C.水力发电 D.农药化肥不合理施用
(4)下列措施不利于环境保护的是___________。
A.推广使用无铅汽油 B.提倡使用太阳能
C.推广使用无磷洗衣粉 D.提倡个人使用多辆汽车
查看答案和解析>>
科目:高中化学 来源: 题型:
有一反应:2A+B 2C,其中A、B、C均为气体,右图中的曲线是
2C,其中A、B、C均为气体,右图中的曲线是
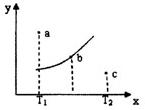 该反应在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,
该反应在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,
图中有a、b、c三点,如图所示,则下列描述正确的是:
A.该反应是放热反应
B.b点时混合气体的平均摩尔质量不再变化
C.T1温度下a点表示若想达到平衡,可以采取增大压强的方法
D.c点可表示v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下:
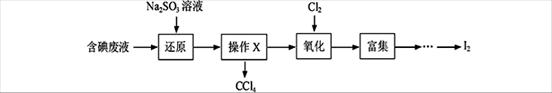
 (1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为 ;该操作将I2还原为I-的目的是 。
(1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为 ;该操作将I2还原为I-的目的是 。
(2)操作X的名称为 。(1分)
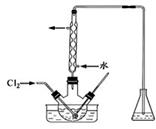
(3)氧化时,在三颈瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在400C左右反应(实验装置如右图所示)。实验控制在较低温度下进行的原因是 ;锥形瓶里盛放的溶液为 。
(4)利用下图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2。
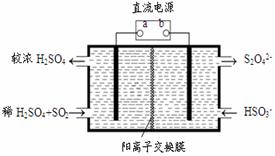
①阳极的电极反应式为 。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。
该反应中氧化剂与还原剂的物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温时,将pH=13的强碱溶液和pH=2的强酸溶液混合,所得溶液的pH=11,则强碱溶液和强酸溶液的体积之比为:( )
A.1:9 B.9:1 C.10:1 D.1:10
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关常见有机物说法正确的是( )
A.乙烯、苯、纤维素均属于烃类化合物
B.天然氨基酸能与强酸或强碱溶液反应
C.石油的蒸馏、裂化属于化学变化
D.地沟油、聚氯乙烯均属于高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
锂及锂盐具有的优异性能和特殊功能,在化工、电子、宇航、核能、能源等领域都得到广泛应用;锂元素更是被誉为“能源元素”。
Ⅰ 锂的原子结构示意图为 ;锂暴露在湿空气中时,会迅速地失去金属光泽、表面开始变黑,更长时间则变成白色。生成的化合物是氮化锂、氢氧化锂,最终生成碳酸锂。写出生成氮化锂的化学方程式 。锂在空气中燃烧,发出浅蓝色的火焰,放出浓厚的白烟,生成相应氧化物 (填化学式)。
Ⅱ 下面是从锂辉石(Li2O·Al2O3·SiO2)中提出锂的工业流程示意图。
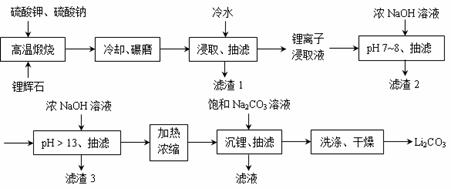
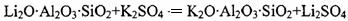 ①高温煅烧时的反应原理为:
①高温煅烧时的反应原理为:
 |
②锂离子浸取液中含有的金属离子为:K+、Na+、Li+、Fe3+、Fe2+、Al3+、Mn2+ 。
③几种金属离子沉淀完全的pH
| 金属离子 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 |
| 沉淀完全的pH | 4.7 | 9.0 | 3.2 | 10.1 |
④Li2SO4、Li2CO3在不同温度下的溶解度(g / 100g水)
| 温度 溶解度 | 10 | 20 | 50 | 80 |
| Li2SO4 | 35.4 | 34.7 | 33.1 | 31.7 |
| Li2CO3 | 1.43 | 1.33 | 1.08 | 0.85 |
(1)浸取时使用冷水的原因是 。
(2)滤渣2的主要成分为 。
(3)流程中分2次调节pH(pH7~8和pH > 13),有研究者尝试只加一次浓NaOH溶液使pH > 13,结果发现在加饱和碳酸钠溶液沉锂后,随着放置时间延长,白色沉淀增加,最后得到的Li2CO3产品中杂质增多。Li2CO3产品中的杂质可能是 ,用离子方程式表示其产生的原因 。
(4)加热浓缩的作用是 。
(5)洗涤Li2CO3晶体使用 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com