
| A. | 工厂中常用的静电除尘装置是根据胶体粒子的带电性而设计的 | |
| B. | 过氧化钠(Na2O2)常用于呼吸面具或潜水艇中作为氧气的来源 | |
| C. | 波尔多液(CuSO4)常用来配制农药,主要因为Cu2+具有氧化性 | |
| D. | 明矾[KAl(SO4)2•12H2O]常用于自来水的净化,主要是因为胶体的吸附性 |
分析 A.胶体不带电,胶粒带电;
B.过氧化钠与水、二氧化碳反应生成氧气;
C.Cu2+为重金属离子,能够使蛋白质变性;
D.明矾[KAl(SO4)2•12H2O]作为净水剂是因为明矾溶于水发生水解反应,生成氢氧化铝胶体,氢氧化铝胶体可以吸附杂质.
解答 解:A.工厂中常用的静电除尘装置是根据胶粒带电这个性质而设计的,故A正确;
B.过氧化钠与水、二氧化碳反应生成氧气,可以做呼吸面具或潜水艇中供养剂,故B正确;
C.波尔多液(CuSO4)常用来配制农药是因为Cu2+为重金属离子,能够使蛋白质变性,故C错误;
D.明矾[KAl(SO4)2•12H2O]作为净水剂是因为明矾溶于水发生水解反应,生成氢氧化铝胶体,氢氧化铝胶体可以吸附杂质,故D正确;
故选:C.
点评 本题考查了元素化合物知识,熟悉过氧化钠、蛋白质、明矾的性质是解题关键,注意明矾净水原理的理解,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
| 反应物 | 生成物 | 反应物 | 生成物 |
| 镁和氧气 | 氧化镁 | 镁和水 | 氧化镁和氢气 |
| 镁和氮气 | 氮化镁 | 氮化镁和水 | 氢氧化镁和氨气 |
| 镁和二氧化碳 | 氧化镁和碳 |
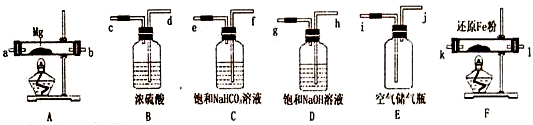
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
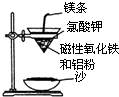 某校高三同学高考前重做以下两个课本实验,请你回答实验过程中的相关问题:
某校高三同学高考前重做以下两个课本实验,请你回答实验过程中的相关问题:| 编号 | 温度/℃ | H2SO4体积/mL | KI溶液体积/mL | H2O体积/mL | 淀粉溶液 /mL | 出现蓝色时间/s |
| A | 39 | 10 | 5 | 5 | 1 | 5 |
| B | TB | 10 | 5 | 5 | 1 | 没出现蓝色 |
| C | 5 | 10 | 5 | 5 | 1 | 39 |
| D | t |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ④CH≡CH ⑤NH3 ⑥CH4.
④CH≡CH ⑤NH3 ⑥CH4.| A. | ①②③ | B. | ①⑤⑥ | C. | ②③④ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14.3% | B. | 12.5% | C. | 87.5% | D. | 85.7% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 第三周期元素的简单离子中半径最小 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式相同,各元素的质量分数也相同的物质是同种物质 | |
| B. | 通式相同的不同物质一定是同分异构体 | |
| C. | 分子式相同的不同物质一定是同分异构体 | |
| D. | 相对分子质量相同的不同物质一定是同分异构体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com