
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101kPa下测得的热量).
(1)反应的热化学方程式为 .
(2)又已知H2O(l)=H2O(g)△H=+44kJ/mol.则16g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ.
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 .
考点: 热化学方程式;有关反应热的计算.
专题: 化学反应中的能量变化.
分析: (1)依据反应物和生成物配平书写化学方程式,根据定律关系判断,0.4mol液态肼和0.8mol H2O2混合恰好反应,所以1mol液态肼完全反应放出641.75kJ的热量;
(2)H2O(l)=H2O(g)△H=+44kJ/mol;依据盖斯定律计算分析得到;
(3)依据产物判断生成物质无污染.
解答: 解:(1)反应方程式为:N2H4+2H2O2=N2+4H2O,0.4mol液态肼放出256.7KJ的热量,则1mol液态肼放出的热量为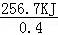 =641.75kJ,
=641.75kJ,
所以反应的热化学方程式为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=﹣641.75kJ/mol,
故答案为:N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)△H=﹣641.75kJ/mol;
(2)①N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=﹣641.75kJ/mol;②H2O(l)=H2O(g)△H=+44kJ/mol;
依据盖斯定律①﹣②×4得到N2H4(l)+2H2O2(l)═N2(g)+4H2O(l)△H=﹣817.75KJ/mol,
16g液态肼物质的量=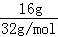 =0.5mol,
=0.5mol,
所以16g液态肼与液态双氧水反应生成液态水时放出的热量是408.875KJ,故答案为:408.875;
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是产物为氮气和水,是空气成分不会造成环境污染,故答案为:产物不会造成环境污染.
点评: 本题考查热化学方程式的书写,盖斯定律的计算判断,反应热的计算应用,注意盖斯定律的应用,题目难度中等.


科目:高中化学 来源: 题型:
下列关于丙烯(CH3﹣CH=CH2)的说法正确的( )
A. 丙烯分子有8个σ键,1个π键
B. 丙烯分子中3个碳原子都是sp3杂化
C. 丙烯分子不存在非极性键
D. 丙烯分子中3个碳原子在同一直线
查看答案和解析>>
科目:高中化学 来源: 题型:
已知热化学方程式:
2H2O(l)=2H2(g)+O2(g);△H1=+571.6kJ/mol,
2H2(g)+O2(g)=2H2O(g);△H2=﹣483.6kJ/mol.
当1g 液态水变成气态水时,对其热量变化的下列描述:
①放出;②吸收;③2.44kJ;④4.88kJ;⑤88kJ,
其中正确的是()
A. ②和⑤ B. ①和③ C. ②和④ D. ②和③
查看答案和解析>>
科目:高中化学 来源: 题型:
科学家盖斯曾提出:“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的.”利用盖斯定律可测某些特别反应的热效应.
(1)P4(s,白磷)+5O2(g)=P4O10(s)△H1=﹣2983.2kJ/mol
(2)P(s,红磷)+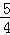 O2(g)=
O2(g)=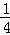 P4O10(s)△H2=﹣738.5kJ/mol
P4O10(s)△H2=﹣738.5kJ/mol
则白磷转化为红磷的热化学方程式 .相同的状况下,能量较低的是 ;白磷的稳定性比红磷 (填“高”或“低”).
查看答案和解析>>
科目:高中化学 来源: 题型:
火法炼铜得到的粗铜中含多种杂质(如锌、金和银等),其性能远不能达到电气工业的要求,工业上常使用电解精炼法将粗铜提纯.在电解精炼时()
A. 粗铜接电源负极
B. 纯铜作阳极
C. 杂质都将以单质形式沉积到池底
D. 纯铜片增重2.56g,电路中通过电子为0.08mol
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol•L﹣1,工作一段时间后,测得两端导线中均通过0.02mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是()
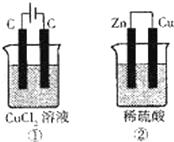
A. 产生气体的体积:①>②
B. 两极上析出物质的质量:①>②
C. 溶液的pH变化:①增大,②减小
D. 电极反应式:①中阳极:4OH﹣﹣→2H2O+O2↑+4e﹣;②中阴极:2H++2e﹣﹣→H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,用0.10 mol·L-1盐酸分别滴定20.00 mL 0.10 mol·L-1氢氧化钠溶液和氨水,滴定过程中溶液pH随加入盐酸体积的变化关系如图所示。下列说法不正确的是( )
A.Ⅱ表示的是滴定氨水的曲线,当V(HCl)=20 mL时,有:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.当pH=7时,滴定氨水消耗的V(HCl)=20 mL,且c(NH4+)=c(Cl-)
C.滴定氢氧化钠溶液时,若V(HCl)>20 mL,则一定有:c(Cl-)>c(Na+)>c(OH-)>c(H+)
D.当滴定氨水消耗V(HCl)=10 mL时,有:2=c(NH4+)-c(NH3·H2O)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com