
分析 (1)根据方案一 Al$\stackrel{H_{2}SO_{4}}{→}$Al2(SO4)3 $\stackrel{NaOH}{→}$Al(OH)3 方案二 Al$\stackrel{NaOH}{→}$NaAlO2$\stackrel{H_{2}SO_{4}}{→}$Al(OH)3则设都生成1mol氢氧化铝,根据原子守恒判断哪种方案节约药品;
(2)AlCl3溶液与氨水反应生成氯化铵和氢氧化铝沉淀,氨水为弱电解质,不能溶解氢氧化铝;
(3)氯气具有氧化性,能将亚铁离子和溴离子氧化,亚铁离子还原性较强,根据电子得失守恒求出被氧化的Br-的物质的量;
(4)计算氧元素质量分数,根据化学式中元素质量之比列方程计算;
(5)在铁与铜的混合物中,加入不足量的稀硝酸,再加入稀硫酸,因硝酸根在酸性条件下具有强氧化性,故剩余金属无论是铁还是铜还是铁铜混合物,都会溶解,以此来解答;
(6)活泼金属铁作电解池阳极时,电解氢氧化钠溶液的电解方程式为Fe+2H2O$\frac{\underline{\;电解\;}}{\;}$H2+Fe(OH)2↓,氢氧化亚铁不稳定,能被氧气氧化成氢氧化铁沉淀,反应方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,结合反应的方程式计算.
解答 解:(1)根据方案一 Al$\stackrel{H_{2}SO_{4}}{→}$Al2(SO4)3 $\stackrel{NaOH}{→}$Al(OH)3 方案二 Al$\stackrel{NaOH}{→}$NaAlO2$\stackrel{H_{2}SO_{4}}{→}$Al(OH)3则设都生成1mol氢氧化铝,根据原子守恒方案一 消耗硫酸1.5mol,消耗氢氧化钠也是1.5mol,而方案二消耗氢氧化钠1mol,硫酸0.5mol,所以方案二较好,
故答案为:方案二较好;
(2)氨水为弱电解质,不能溶解氢氧化铝,离子方程式中应写化学式,AlCl3溶液与氨水反应生成氯化铵和氢氧化铝沉淀,反应的离子方程式为A13++3NH3•H2O=Al(OH)3↓+3NH4+,
故答案为:A13++3NH3•H2O=Al(OH)3↓+3NH4+;
(3)氯气具有氧化性,能将亚铁离子和溴离子氧化,先氧化亚铁离子,1L 0.4mol/L即0.4mol的FeBr2溶液中通入标况下的6.72L即$\frac{6.72L}{22.4L/mol}$=0.3molCl2反应时,此时Fe2+全部被氧化,溴离子部分被氧化,根据电子得失守恒:n(Cl2)×2=n(Fe2+)×1+n(Br-)×1,即0.3mol×2=0.4mol×1+n(Br-)×1,则n(Br-)=0.2mol,此时离子方程式为:3Cl2+4Fe2++2Br-=6Cl-+4Fe3++Br2,
故答案为:3Cl2+4Fe2++2Br-=6Cl-+4Fe3++Br2;
(3)铁的某种氧化物的化学式表示为Fex0(x<1),铁元素在该氧化物中的质量分数为76.3%,则氧元素质量分数为23.7%,故56x:16=76.3%:23.7%,解得x=0.92,设氧化物中的Fe分别为Fe2+、Fe3+,物质的量分别为x,y,则根据化学式有$\left\{\begin{array}{l}{2x+3y=2}\\{x+y=0.92}\end{array}\right.$,解得x=0.76,y=0.16,所以n(Fe2+):n(Fe3+)=19:4,
故答案为:0.92;19:4;
(5)铁和铜都和硝酸反应生成硝酸盐,充分反应后剩余金属的质量为m1g,剩余金属一定含Cu,可能还含Fe;再加入硫酸,提供氢离子,在酸性条件下,硝酸盐中的硝酸根具有强氧化性,故再与剩余金属反应,故m1一定大于m2,
故答案为:大于;
(6)根据铁原子守恒知,4molFe(OH)3~4molFe(OH)2,所以生成4molFe(OH)3需要4molFe(OH)2;活泼金属铁作电解池阳极时,电解氢氧化钠溶液的电解方程式为Fe+2H2O$\frac{\underline{\;电解\;}}{\;}$H2+Fe(OH)2↓,根据电解方程式得,生成4molFe(OH)2需要水的物质的量为8mol;又氢氧化亚铁不稳定,能被氧气氧化成氢氧化铁沉淀,反应方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,根据方程式得,生成4molFe(OH)3需要水的物质的量为2mol,所以得到4molFe(OH)3沉淀消耗水的物质的量共为10mol,故答案为:10.
点评 本题比较综合,主要考查学生阅读题目获取信息的能力、氢氧化铝的制备方案的分析、氧化还原反应等,题目难度中等,要求学生要有扎实的基础知识和灵活运用知识解决问题的能力.注意基础知识的全面掌握,注意氢氧化铝的两性.


科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图:可能用到的有关数据如下:
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图:可能用到的有关数据如下:| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
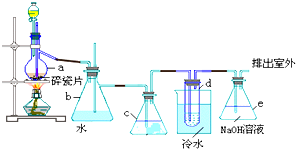
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ③④ | C. | ②③ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验 序号 | 温度℃ | 初始CCl4浓度 (mol•L-1) | 初始H2浓度(mol•L-1) | CCl4的平衡转化率 |
| 1 | 110 | 1 | 1.2 | A |
| 2 | 110 | 1 | 1 | 50% |
| 3 | 100 | 1 | 1 | B |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳酸钠一过氧化氢加合物(aNa2CO3•bH2O2)具有漂白、杀菌作用.实验室用“醇析法”制备该物质的实验步骤如下:
碳酸钠一过氧化氢加合物(aNa2CO3•bH2O2)具有漂白、杀菌作用.实验室用“醇析法”制备该物质的实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
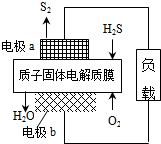 H2S废气资源化利用途径之一是回收能量并得到单质硫.反应原理为:2H2S(g)+O2(g)═S2(s)+2H2O(l)△H=-632kJ•mol-1.如图为质子膜H2S燃料电池的示意图.下列说法正确的是( )
H2S废气资源化利用途径之一是回收能量并得到单质硫.反应原理为:2H2S(g)+O2(g)═S2(s)+2H2O(l)△H=-632kJ•mol-1.如图为质子膜H2S燃料电池的示意图.下列说法正确的是( )| A. | 电极a为电池的正极 | |
| B. | 电极b上发生的电极反应为:O2+2H2O+4e-=4 OH- | |
| C. | 电路中每流过4mol电子,电池内部释放632kJ热能 | |
| D. | 每17gH2S参与反应,有1mol H+经质子膜进入正极区 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com