
【题目】KI溶液在酸性条件下能与氧气反应。现有以下实验记录:

回答下列问题:
(1)该反应的离子方程式为_____________________________________。
(2)该实验的目的是__________________________________。
(3)实验试剂除了1 mol·L-1KI溶液、0.1 mol·L-1H2SO4溶液外,还需要的试剂是________,实验现象为_____________________________。
(4)上述实验操作中除了需要(3)的条件外,还必须控制不变的是________(填字母)。
A.温度
B.试剂的浓度
C.试剂的用量(体积)
D.试剂添加的顺序
(5)由上述实验记录可得出的结论是_________________________。
(6)若要进行溶液酸性大小对反应速率的影响的探究实验,你会采取的措施是_________。
【答案】4H++4I-+O2===2I2+2H2O 探究温度对反应速率的影响 淀粉溶液 无色溶液变蓝 CD 每升高10 ℃,反应速率增大约2倍 保持其他实验条件不变,采用不同浓度的硫酸溶液进行对比实验
【解析】
(1)根据反应物和生成物书写离子方程式;
(2)根据表中数据分析该实验目的;
(3)为测定显色时间,产物中有碘单质生成,还需要的试剂是淀粉溶液,据此判断;
(4)设计实验必须保证其他条件不变,只改变一个条件,才能得到准确的结论,结合表中数据分析;
(5)结合表中数据分析结论;
(6)若要进行酸性对反应速率的影响的探究实验,采用不同浓度的硫酸溶液进行对比实验。
(1)氧气在酸性溶液中氧化碘离子生成单质碘,同时还有水生成,该反应的离子方程式为4H++4I-+O2=2I2+2H2O;
(2)根据表中数据分析,该实验目的是探究温度对反应速率的影响;
(3)为测定显色时间,产物中有碘单质生成,因此还需要的试剂是淀粉溶液,实验现象为无色溶液变蓝色;
(4)设计实验必须保证其他条件不变,只改变一个条件,才能得到准确的结论,因此根据以上分析可知还必须控制不变的是试剂的用量(体积)和试剂添加的顺序,故答案为CD;
(5)通过表中数据分析可得出的结论是每升高10℃,反应速率增大约2倍;
(6)若要进行酸性对反应速率的影响的探究实验,你会采取的措施是保持其他实验条件不变,采用不同浓度的硫酸溶液进行对比实验。


 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案 小学学习好帮手系列答案
小学学习好帮手系列答案科目:高中化学 来源: 题型:
【题目】原子序数依次增大的短周期主族元素X、Y、Z、W、R,其中X、Y两种元素的核电荷数之差等于它们的原子最外层电子数之和;Y、Z位于相邻主族;Z是地壳中含量最高的元素;X、W是同主族元素。上述五种元素两两间能形成四种常见的化合物甲、乙、丙、丁,这四种化合物中原子个数比如下表:
甲 | 乙 | 丙 | 丁 | |
化合物中各元素原子个数比 |
|
|
|
|
(1)写出下列元素符号:Y_____________,Z_______________,W_____________,R________________。
(2)写出下列化合物的电子式:乙_______________,丙__________________。
(3)向甲的水溶液中加入丁,有淡黄色沉淀生成,请写出反应的化学方程式:__________________。
(4)甲和乙反应能放出大量的热,同时生成两种无污染的物质,请写出该反应的化学方程式:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应速率和限度的说法中,正确的是( )
A.铁与硝酸反应时,其他条件一定时,硝酸越浓,反应速率越快
B.在金属钠与足量水反应中,增加水的量能加快反应速率
C.在2SO2+O2![]() 2SO3反应中加入18O2,达到平衡后SO2中不可能含有18O2
2SO3反应中加入18O2,达到平衡后SO2中不可能含有18O2
D.无论是吸热还是放热反应,加热都能加快化学反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铁是一种重要的无机材料,化学性质稳定,催化活性高,具有良好的耐光性、耐热性和对紫外线的屏蔽性,从某种工业酸性废液(主要含Na+、Fe2+、Fe3+、Mg2+、Al3+、Cl-、SO42-)中回收氧化铁流程如下:

已知:常温下Ksp[Mg(OH)2]=1.2×10-11;Ksp[Fe(OH)2]=2.2×10-16;Ksp[Fe(OH)3]=3.5×10-38;Ksp[Al(OH)3]=1.0×10-33
(1)写出在该酸性废液中通入空气时发生的离子反应方程式:___________,指出使用空气的优点是:_________。
(2)已知Fe3+(aq)+3OH-(aq)===Fe(OH)3(s)ΔH=-Q1kJ·mol-1,题(1)中每生成1 mol含铁微粒时,放热Q2,请你计算1 mol Fe2+全部转化为Fe(OH)3(s)的热效应ΔH=_________。
(3)常温下,根据已知条件计算在pH=5的溶液中,理论上下列微粒在该溶液中可存在的最大浓度c(Fe3+)=___________,c(Mg2+)=___________。
(4)有人用氨水调节溶液pH,在pH=5时将Fe(OH)3沉淀出来,此时Fe(OH)3沉淀中可能混有的杂质是______ (填化学式,下同),用_______试剂可将其除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)为了验证 Fe2+与 Cu2+氧化性强弱,下列装置能达到实验目的的是_______(填装置序号), 其正极的电极反应式为_______;若构建该原电池时两个电极的质量相等,当导线中通过 0.4 mol 电子时,两个电极的质量差为_______g。

(2)将 CH4 设计成燃料电池,其利用率更高,装置如图所示(A、B 为多孔碳棒)。
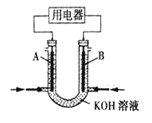
实验测得 OH- 定向移向 A 电极,则_______(填 A 或 B)处电极入口通 CH4,其电极反应式为_______。
(3)金属冶炼和处理常涉及氧化还原反应。由下列物质冶炼相应金属时采用电解法的是_______(填选 项字母)。
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应;C2H5OH+HBr![]() C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
A. 加入NaOH,可增大乙醇的物质的量
B. 增大HBr浓度,有利于生成C2H5Br
C. 若反应物增大至2 mol,则两种反应物平衡转化率之比不变
D. 若起始温度提高至60℃,可缩短反应达到平衡的时间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微型纽扣电池在现代生活中有广泛应用。有一种银锌电池,其电极材料分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应式为Zn+2OH2e===Zn(OH)2,Ag2O+H2O+2e===2Ag+2OH。下列叙述中正确的是( )
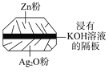
A. 在使用过程中,电解质KOH不断被消耗
B. 使用过程中,电子由Ag2O极经外电路流向Zn极
C. Zn电极发生还原反应,Ag2O电极发生氧化反应
D. Zn是负极,Ag2O是正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由反应物 X 分别转化为 Y 和 Z 的能量变化如图所示。下列说法正确的是( )
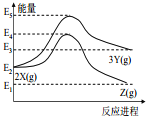
A.由 X→Z 反应的 ΔH<0 B.由 X→Y 反应的 ΔH=E5-E2
C.增大压强有利于提高 Y 的产率 D.升高温度有利于提高 Z 的产率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在20℃,5.05×105Pa条件下,密闭容器中进行反应2A(g)+xB(g)![]() 4C(g),达平衡时c(A)=1.00molL-1,现将压强减小到1.01×105Pa,建立平衡后,c(A)=0.18molL-1,则下列说法正确的是 ( )
4C(g),达平衡时c(A)=1.00molL-1,现将压强减小到1.01×105Pa,建立平衡后,c(A)=0.18molL-1,则下列说法正确的是 ( )
A.系数x >2
B.若增大该体系的压强,平衡向左移动,化学平衡常数变小
C.若增大该体系的压强,平衡向右移动,化学平衡常数不变
D.该反应的化学平衡常数表达式是K=![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com