
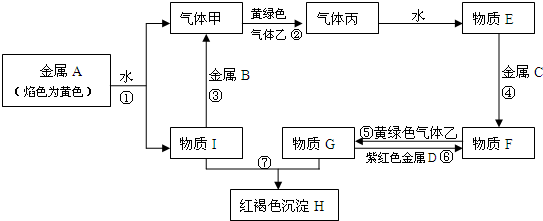
分析 金属A焰色反应为黄色,故A为Na,乙是黄绿色气体,则乙为Cl2,H为红褐色沉淀,为Fe(OH)3;由反应①Na+水→气体甲+I,故甲为H2,I为NaOH,由NaOH+金属B→H2可知,B为金属Al,由甲+乙→丙,故丙为HCl,HCl溶于水的物质E,故E为盐酸;G+NaOH→Fe(OH)3,G含有Fe3+,由E(盐酸)$\stackrel{金属(C)}{→}$F$\stackrel{Cl_{2}}{→}$G可知,C为Fe,F为FeCl2,G为FeCl3,紫红色金属D为Cu.
解答 解:金属A焰色反应为黄色,故A为Na,乙是黄绿色气体,则乙为Cl2,H为红褐色沉淀,为Fe(OH)3;由反应①Na+水→气体甲+I,故甲为H2,I为NaOH,由NaOH+金属B→H2可知,B为金属Al,由甲+乙→丙,故丙为HCl,HCl溶于水的物质E,故E为盐酸;G+NaOH→Fe(OH)3,G含有Fe3+,由E(盐酸)$\stackrel{金属(C)}{→}$F$\stackrel{Cl_{2}}{→}$G可知,C为Fe,F为FeCl2,G为FeCl3,紫红色金属D为Cu.
(1)由上述分析可知,A为Na,B为Al,C为Fe,F为FeCl2,H为Fe(OH)3,乙为Cl2,
故答案为:Na;Al;Fe;FeCl2;Fe(OH)3;Cl2;
(2)反应①的化学方程式:2Na+2H2O=2NaOH+H2↑,
反应⑥的离子方程式:2Fe3++Cu=2Fe2++Cu2+,
故答案为:2Na+2H2O=2NaOH+H2↑;2Fe3++Cu=2Fe2++Cu2+.
点评 本题考查无机物的推断,题目难度中等,需要学生熟练掌握元素化合物知识,注意特殊的颜色与特殊反应是推断的突破口.


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:填空题
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL-1 | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL-1 | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL-1 | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCH4分子中共价键总数为4NA | |
| B. | 18gD2O中含有的质子数目为10NA | |
| C. | 标准状况下,5.6LCCl4含有的分子数为0.25NA | |
| D. | 28gN2和1molCH2=CH2所含电子数都是14NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 具有下列电子式的原子中,①1s22s22p63s23p2、②1s22s22p3、③1s22s22p2、④1s22s22p63s23p4,原子半径最大的是① | |
| B. | 下列原子的价电子排布中,①3s23p1②3s23p2③3s23p3④3s23p4对应的第一电离能最大是③ | |
| C. | 某元素的逐级电离能分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X3+ | |
| D. | ①Na、K、Rb,②N、P、As,③O、S、Se,④Na、P、Cl 元素的电负性随原子序数增大而递增的是④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+,当加入一种淡黄色固体并加热溶液时,有刺激性气味气体放出和白色沉淀生成.加入淡黄色固体的物质的量(横坐标)与析出沉淀和产生气体的物质的量(纵坐标)的关系如图所示,据图可推知溶液中含有的离子是Mg2+、Al3+、NH4+,它们的物质的量浓度之比为c(Mg2+):c(Al3+):c(NH4+)=1:1:3,所加淡黄色固体是Na2O2(填化学式).
某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+,当加入一种淡黄色固体并加热溶液时,有刺激性气味气体放出和白色沉淀生成.加入淡黄色固体的物质的量(横坐标)与析出沉淀和产生气体的物质的量(纵坐标)的关系如图所示,据图可推知溶液中含有的离子是Mg2+、Al3+、NH4+,它们的物质的量浓度之比为c(Mg2+):c(Al3+):c(NH4+)=1:1:3,所加淡黄色固体是Na2O2(填化学式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇分子比例模型: | |
| B. | 醛基的电子式: | |
| C. |  的名称为:2,4,4-三甲基-1-戊烯 的名称为:2,4,4-三甲基-1-戊烯 | |
| D. | 乙酸、葡萄糖、淀粉的最简式均为CH2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | H2通入负极区 | B. | O2通入负极区 | ||
| C. | 负极反应为2H2-4e-═4H+ | D. | 溶液中OH-由正极向负极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①②③ | B. | ①④⑤ | C. | ①②④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com