
由K2SO4、Al2(SO4)3、H2SO4及KAl(SO4)2·12H2O组成的混合溶液,测得c(H+)=0.1 mol·L-1,c(Al3+)=0.4 mol·L-1,c(SO42-)=0.8 mol·L-1,则c(K+)为( )
A.0.15 mol·L-1 B.0.2 mol·L-1 C.0.3 mol·L-1 D.0.4 mol· L-1
科目:高中化学 来源:2017届安徽省安庆市等六校高三第一次联考化学试卷(解析版) 题型:选择题
下列说法不正确的是( )
①铝和铜具有良好的导电性,所以电工操作时,可以把铜线和铝线拧在一起
②汽车尾气中含有能污染空气的氮氧化物,主要是汽油燃烧不充分造成的
③从海水中提取物质都必须通过化学反应才能实现
④“辽宁舰”上用于舰载机降落拦阻索的特种钢缆属于新型无机非金属材料
⑤明矾可以用于净水,主要是由于Al3+水解生成的少量氢氧化铝胶体有净水作用
A.②③⑤ B.①②④ C.①③④⑤ D.①②③④
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江哈尔滨师大附中高二上期中化学卷(解析版) 题型:选择题
下列有关问题,与盐的水解有关的是
①NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂 ②用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂 ③草木灰与铵态氮肥不能混合施用 ④实验室盛放Na2CO3溶液的试剂瓶不能用磨口玻璃塞 ⑤加热蒸干AlCl3溶液得到Al(OH)3固体
A.①②③ B.②③④ C.①④⑤ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江哈尔滨六中高一上期中化学试卷(解析版) 题型:实验题
硫酸
分子式:H2SO4
相对分子质量:98
密度:1.84g/mL
H2SO4的质量分数:98%
(1)该浓硫酸中H2SO4的物质的量浓度为 。
(2)某学生欲用上述浓硫酸和蒸馏水配制250mL物质的量浓度为0.4 mol·L-1的稀硫酸,该学生需要量取 mL上述浓硫酸进行配制。
(3)为配制(2)中的稀硫酸,下列可供选用的仪器中,一定用到的是 (填编号),配制过程中还缺少的仪器是 。(填写仪器名称)
①玻璃棒; ②胶头滴管;③量筒;④药匙;⑤圆底烧瓶;⑥天平;⑦烧杯;⑧普通漏斗
(4)在配制过程中,下列实验操作可能导致配制的硫酸溶液浓度偏高的是 (填序号)。
①定容时俯视观察
②定容后经振荡、摇匀、静置后,发现液面下降,再加适量的蒸馏水
③浓硫酸在烧杯中加水稀释后,未冷却就向容量瓶中转移
④容量瓶使用时未干燥
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江哈尔滨六中高一上期中化学试卷(解析版) 题型:选择题
下列有关物质分类一定正确的是 ( )
A.强电解质:盐酸、氢氧化钡、明矾 B.弱电解质:甲酸、纯碱、醋酸铵
C.非电解质:液氨、二氧化硫、苯 D.同系物:CH2O2、C2H4O2、C3H6O2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江哈尔滨六中高一上期中化学试卷(解析版) 题型:选择题
已知I-、Fe2+、SO2和H2O2均有还原性,在酸性溶液中还原能力的强弱顺序为H2O2<Fe2+<I-<SO2,则下列反应不能发生的是( )
A.2Fe3++SO2+2H2O=2Fe2++SO +4H+
+4H+
B.H2O2+H2SO4=SO2↑+O2↑+2H2O
C.I2+SO2+2H2O=H2SO4+2HI
D.2Fe3++2I-=2Fe2++I2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江哈尔滨六中高一上期中化学试卷(解析版) 题型:选择题
下列对实验过程的评价正确的是( )
A.某固体中加入稀盐酸,产生了无色气体,证明该固体一定是CaCO3
B.某溶液中滴加BaCl2溶液,生成不溶于稀硝酸的白色沉淀,该溶液中一定含SO
C.某无色溶液中滴入无色酚酞显红色,该溶液一定显碱性
D.验证烧碱溶液中是否含有Cl-,先加稀盐酸除去OH-,再加AgNO3溶液,有白色沉淀出现,证明含Cl-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江哈尔滨六中高二上期中化学试卷(解析版) 题型:选择题
1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,则该碱溶液的pH等于( )
A.9.0 B.9.5 C.10.5 D.11.0
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆中学高二上期中化学试卷(解析版) 题型:实验题
某同学用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaO H溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.
H溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.
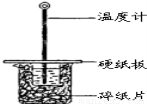
(1)下列说法不正确的是( )
A.该实验也可在保温杯中进行
B.图中实验装置缺少环形玻璃搅拌棒
C.烧杯间填满碎纸条的作用是保温、隔热,减少热量损失
D.若将盐酸体积改为60mL,两次实验所求得中和热不相等
(2)若通过实验测定中和热的△H的绝对值常常小于57.3kJ/mol,其原因可能是_________
A.实验装置保温、隔热效果差
B.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
C.量取NaOH溶液的体积时仰视读数
D.用温度计测定盐酸初始温度后,直接测定氢氧化钠溶液的温度
(3)将一定量的稀氨水、稀氢氧化钠溶液、稀氢氧化钡溶液分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为__________;
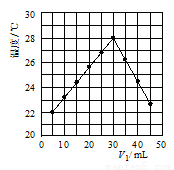
(4)若将V1mL1.0mol•L-1 HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).由图2可知,氢氧化钠的浓度为 __________ ;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com