
分析 (1)根据稀释前后溶质的物质的量不变,计算出浓溶液的体积,选取合适的量筒,再根据配制一定物质的量浓度的溶液需要量取、溶解、移液、洗涤、定容、摇匀等操作解答;
(2)稀释前后溶质的物质的量不变,进行解答;
(3)①再根据配制一定物质的量浓度的溶液需要量取、溶解、移液、洗涤、定容、摇匀等;
②在小烧杯内稀释浓硫酸,稀释时要用玻璃棒不断搅拌,转移溶液时玻璃棒引流的作用;
③a中98%的浓H2SO4的物资的量浓度为c=$\frac{1000ρw}{98}$=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,配制1.84mol/L的稀硫酸100mL,需要浓硫酸的体积为V═$\frac{0.1×1.84}{18.4}$=0.01L=10mL,应选择10ml量筒,h中将配制好的溶液转移入含少量蒸馏水的试剂瓶中无形中对溶液进稀释;
④分析操作对溶质的物质的量或对溶液的体积的影响,根据c=$\frac{n}{v}$分析判断.
解答 解:(1)98%的浓H2SO4的物资的量浓度为c=$\frac{1000ρw}{98}$=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,配制1.84mol/L的稀硫酸100mL,需要浓硫酸的体积为V═$\frac{0.1×1.84}{18.4}$=0.01L=10mL,应选择10ml量筒,因配制一定物质的量浓度的溶液需要量取、溶解、移液、洗涤、定容时用胶头滴管小心加蒸馏水至刻度线、摇匀等操作,所以应选用的仪器是玻璃棒、10mL量筒、50mL烧杯、100mL容量瓶、胶头滴管,故选CEFGH;
(2)稀释前后溶质的物质的量不变,则1mol/L×0.100L=18.4mol/L×V,解之得V=5.4mL,故答案为:5.4;
(3)①再根据配制一定物质的量浓度的溶液需要量取、溶解、移液、洗涤、定容、摇匀等,所以正确的顺序为:adbcegfh,故答案为:adbcegfh;
②在小烧杯内稀释浓硫酸,稀释时要用玻璃棒不断搅拌,转移溶液时玻璃棒引流的作用,故答案为:搅拌和引流;
③a中98%的浓H2SO4的物资的量浓度为c=$\frac{1000ρw}{98}$=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,配制1.84mol/L的稀硫酸100mL,需要浓硫酸的体积为V═$\frac{0.1×1.84}{18.4}$=0.01L=10mL,应选择10ml量筒,h中将配制好的溶液转移入含少量蒸馏水的试剂瓶中无形中对溶液进稀释;故答案为:量取硫酸的量筒量程太大,会造成较大误差 试剂瓶未干燥,会使所配溶液变稀;
④I 转移硫酸后,小烧杯未洗涤,溶质的物质的量偏小,物质的量减少,所以浓度偏低,故答案为:偏低;
II.量筒为流量式仪器,将量筒洗涤后的洗涤液不能转移至容量瓶,否则会导致容量瓶内硫酸的物质的量增多,浓度偏高,故答案为:偏高;
III.定容时俯视读数,会导致溶液体积偏小,则浓度偏高,故答案为:偏高.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:多选题
| A. | 向溶解有Na2O2的水溶液中滴入2滴酚酞试液,溶液先变红振荡后褪色 | |
| B. | 氯气的性质活泼,它与氢气混合后立即发生爆炸 | |
| C. | 铁在纯氧中燃烧或高温下和水蒸气反应均能得到黑色Fe3O4 | |
| D. | 新制的氯水加入有色布条褪色,说明溶液中有Cl2存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m-13=n | B. | n+5=m | C. | m+8=n | D. | n-11=m |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 编号 | 实验内容 | 实验原理 | 气体发生装置 |
| ① | 制备氧气 | H2O2→O2 | Ⅲ |
| ② | 制备二氧化硫 | Na2SO3→SO2 | Ⅲ |
| ③ | 制备氯气 | HCl→Cl2 | Ⅰ或Ⅲ |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
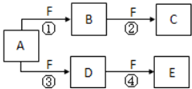 X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍.A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示:
X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍.A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示: .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | |||||||
| 3 | ② | ③ | ④ | ⑤ | ⑦ | |||
| 4 | ⑥ | ⑧ |
 .写出实验室里制取该气体的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
.写出实验室里制取该气体的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:Z>Y>X>W | |
| B. | X、Y、Z、W 形成的单质最多有 6 种 | |
| C. | X 元素最高价氧化物对应水化物的化学式为:H3XO4 | |
| D. | 四种元素的气态氢化物中,W 的气态氢化物最稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 18g 冰(图甲)中含 O-H 键数目为 4NA | |
| B. | 28g 晶体硅(图乙)中含有σ键数目为 2NA | |
| C. | 44g 干冰(图丙)中含有 NA个晶胞结构单元 | |
| D. | 石墨烯(图丁)是碳原子单层片状新材料,12g 石墨烯中含π键数目为 1.5NA |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高二上月考一化学卷(解析版)) 题型:选择题
某温度下,已知反应mX(g)+nY(g) 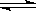 qZ(g)△H>0,m+n>q,在体积一定的密闭容器中达到平衡,下列叙述正确的是
qZ(g)△H>0,m+n>q,在体积一定的密闭容器中达到平衡,下列叙述正确的是
A.反应速率v正(X)=m/n v逆(Y)
B.降低温度,c(Y)/c(Z)的值变小
C.增加Y的物质的量,X的转化率增大
D.加入X,反应的△H增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com